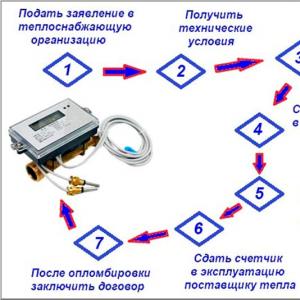
Эрхэм хийн нэгдлүүд, тэдгээрийн үйлдвэрлэл, шинж чанарууд. Инерцийн хийн клатрат нэгдлүүд. Язгууртны үүргийн тухай уянгын ухралт
Гаднах электрон түвшний бүрэн бүтэн байдлаас шалтгаалан үнэт хий нь химийн хувьд маш идэвхгүй байдаг. 1962 он хүртэл тэд химийн нэгдлүүдийг огт үүсгэдэггүй гэж үздэг байв. Энэ үед клатрат төрлийн зарим нэгдлүүдийг олж авсан бөгөөд тэдгээрт язгуур хийн атом нь механикаар (химийн холбоо үүсгэхгүйгээр) өөр бодисын молекулуудаас бүрдсэн хүрээн дотор байрладаг. Жишээлбэл, аргоныг хэт хөргөсөн усан дээр хүчтэй шахах үед болор гидрат Ar 6H20 тусгаарлагдсан. Үүний зэрэгцээ, хамгийн эрч хүчтэй исэлдүүлэгч бодис (фтор гэх мэт) -тэй ч гэсэн үнэт хийг хүчээр хариу үйлдэл үзүүлэх гэсэн бүх оролдлого үр дүнгүй болсон. Эрхэм хийн атом бусад элементүүдтэй химийн холбоо үүсгэдэг анхны химийн нэгдлүүдийг 1962 онд Н.Бартлетт олж авчээ. Бартлетт сикамор гексафторид PtF*-тай хийсэн туршилтынхаа нэгэнд химийн шинжилгээний үр дүнгээс үзэхэд 02PtF6 томьёотой, C>2* ба PtF6~ ионуудаас бүрдсэн улаан талстыг олж авсан. Энэ нь PtFfi нь хүчилтөрөгчөөс ч электрон авдаг тийм хүчтэй исэлдүүлэгч бодис гэсэн үг юм. Бартлетт өөр нэг гайхалтай бодисыг исэлдүүлэхээр шийдэж, хүчилтөрөгчөөс электрон авах нь ксеноноос илүү хялбар гэдгийг ойлгосон (иончлолын потенциал: O * хувьд 12.2 эВ, Xe хувьд 12.1 эВ). Тэрээр цагаан алтны гексафторидыг саванд хийж, нарийн хэмжсэн ксеноныг хөөргөж, хэдхэн цагийн дараа ксенон гексафторплатинатыг хүлээн авав: Удалгүй Бартлетт ксеноныг фтортой урвалд оруулав. Шилэн саванд халаахад ксенон нь фгортой сайн урвалд ордог бөгөөд фторын холимог үүсдэг. Ксенон (II) фтор XeF2 нь ердийн температурт ксенон ба фторын холимог дээр өдрийн гэрлийн нөлөөн дор үүсдэг: эсвэл -120 ° C-д ксенон ба F202 харилцан үйлчлэлээр: XeF2 нь усанд уусдаг өнгөгүй талстууд юм. XeF2 молекул нь шугаман хэлбэртэй. XeF2-ийн усан дахь уусмал нь маш хүчтэй исэлдүүлэгч бодис бөгөөд ялангуяа хүчиллэг орчинд бром, марганецыг исэлдүүлэх хамгийн өндөр түвшинд (+7) хүргэдэг. Шүлтлэг орчинд XeF2 нь тэгшитгэлийн дагуу гидролиз болдог: Ксенон (IV) фторид XeF4 нь ксенон ба фторын хольцыг 400С хүртэл халаахад үүсдэг: XeF* өнгөгүй талстууд. XeF4 молекул нь төвд нь ксенон атом бүхий "дөрвөлжин" юм. XeF4 нь маш хүчтэй исэлдүүлэгч бодис бөгөөд фторжуулагч бодис болгон ашигладаг: Устай харилцан үйлчлэхэд XeF4 пропорциональ бус байдаг: XeF6 нь халаалт ба фторын өндөр даралтаар элементүүдээс үүсдэг: XeFe - өнгөгүй талстууд. XeF' молекул нь төв хэсэгт ксенон атом бүхий гажсан октаэдр юм. Бусад ксенон фторидын нэгэн адил XeF6 нь маш хүчтэй исэлдүүлэгч бодис бөгөөд үүнийг фторжуулагч болгон ашиглаж болно: XeF6 нь усаар хэсэгчлэн задардаг: XeF4-ийн гидролизийн явцад Xe03 ксенон (VI) исэл үүсдэг (дээрхийг үзнэ үү). Энэ нь цагаан өнгөтэй, дэгдэмхий бус, тэсэрч дэлбэрэх чадвартай, усанд сайн уусдаг бодис бөгөөд урвалын улмаас уусмал нь бага зэрэг хүчиллэг орчинтой байдаг: XO3-ийн шүлтлэг уусмал дээр озоны нөлөөгөөр ксеноны хүчлийн давс үүсдэг. , ксенон нь 4-8 исэлдэлтийн төлөвтэй байдаг: Ксенон исэл (VIII ) Xe04 нь барийн перксснатыг усгүй хүхрийн хүчилтэй бага температурт урвалд оруулснаар гаргаж авах боломжтой: Xe04 нь маш тэсрэх чадвартай, 0 хэмээс дээш температурт задардаг өнгөгүй хий юм. C: Бусад үнэт хийн нэгдлүүдээс KrF2, KtF4, RnF2, RnF4, RnF6, Rn03. Гели, неон, аргон зэрэг ижил төстэй нэгдлүүдийг бие даасан бодис хэлбэрээр олж авах магадлал багатай гэж үздэг. Гэсэн хэдий ч гелий, неон, аргон зэрэг химийн нэгдлүүд нь эксимер молекул гэж нэрлэгддэг, өөрөөр хэлбэл өдөөгдсөн электрон төлөв нь тогтвортой, үндсэн төлөв нь тогтворгүй байдаг молекулууд хэлбэрээр байдаг. Жишээлбэл, аргон ба хлорын холимгийг цахилгаанаар өдөөхөд эксимер ArCl молекул үүсэх замаар хийн фазын урвал явагдах боломжтой.Үүний нэгэн адил язгуурт хийн өдөөгдсөн атомуудын урвал нь бүхэл бүтэн диатомын молекулуудыг үүсгэж болно. Her, Ne2, NeF гэх мэт Эдгээр бүх молекулууд нь тогтворгүй бөгөөд бие даасан бодис болгон тусгаарлах боломжгүй боловч тэдгээрийг бүртгэж, тэдгээрийн молекулуудын бүтцийг спектроскопийн аргаар судлах боломжтой.
Тогтмол системийн найм дахь бүлгийн гол дэд бүлэг нь язгуур хий - гелий, неон, аргон, криптон, ксенон, радон юм. Эдгээр элементүүд нь маш бага химийн идэвхжилээр тодорхойлогддог бөгөөд энэ нь тэднийг эрхэмсэг эсвэл идэвхгүй хий гэж нэрлэх үндэслэл болсон юм. Тэд зөвхөн бусад элементүүд эсвэл бодисуудтай нэгдэл үүсгэдэг; гелий, неон, аргон зэрэг химийн нэгдлүүдийг олж аваагүй байна. Эрхэм хийн атомууд нь молекулуудад нэгддэггүй, өөрөөр хэлбэл тэдгээрийн молекулууд нь нэг атомт байдаг.
Эрхэм хий нь элементүүдийн системийн үе бүрийг дуусгадаг. Гелигээс гадна тэдгээр нь бүгд атомын гаднах электрон давхаргад найман электронтой бөгөөд маш тогтвортой системийг бүрдүүлдэг. Хоёр электроноос бүрдэх гелийн электрон бүрхүүл нь мөн тогтвортой байдаг. Тиймээс язгууртны хийн атомууд нь өндөр иончлолын энерги, дүрмээр бол электроны сөрөг энергитэй байдаг.
Хүснэгтэнд. 38-д сайн хийн зарим шинж чанар, түүнчлэн агаар дахь агууламжийг харуулав. Эндээс харахад хийн шингэрүүлэх, хатуурах температур нь бага байх тусам тэдгээрийн атомын масс эсвэл серийн дугаар бага байна: гелий шингэрүүлэх температур хамгийн бага, радоны хувьд хамгийн өндөр байна.
Хүснэгт 38. Үнэт хийн зарим шинж чанар, тэдгээрийн агаар дахь агууламж
19-р зууны эцэс хүртэл агаар нь зөвхөн хүчилтөрөгч, азотоос бүрддэг гэж үздэг байв. Харин 1894 онд Английн физикч Ж.Рэйли агаараас гаргаж авсан азотын нягт (1.2572 ) нь түүний нэгдлүүдээс гаргаж авсан азотын нягтаас (1.2505 ) тодорхой хэмжээгээр их болохыг тогтоожээ. Химийн профессор В.Рамсей нягтын ялгаа нь атмосферийн азот дахь зарим хүнд хий байгаатай холбоотой гэж үзсэн. Азотыг улаан халуун магнитай (Рамсей) холбох эсвэл цахилгаан гүйдэл үүсгэх замаар хүчилтөрөгчтэй (Рэйлей) нэгтгэх замаар хоёр эрдэмтэн агаар мандлын азотоос бага хэмжээний химийн идэвхгүй хийг тусгаарласан. Ийнхүү тэр цаг хүртэл үл мэдэгдэх аргон хэмээх элемент нээгдэв. Аргоны дараа агаарт бага хэмжээгээр агуулагдах гели, неон, криптон, ксеноныг тусгаарласан. Дэд бүлгийн сүүлчийн элемент болох радон нь цацраг идэвхт хувирлыг судлах явцад олдсон.
Аргоныг нээхээс 11 жилийн өмнө 1883 онд, хувьсгалт хөдөлгөөнд оролцсоныхоо төлөө 1882 онд шоронд хоригдож байсан Оросын эрдэмтэн II А. хаант засгийн газраас Шлиссельбургийн цайз руу. Н.А.Морозов үечилсэн систем дэх үнэт хийн байршлыг зөв тодорхойлж, атомын нарийн төвөгтэй бүтэц, элементүүдийг нийлэгжүүлэх, атомын дотоод энергийг ашиглах боломжийн талаар санаа дэвшүүлсэн. Н.А.Морозов 1905 онд шоронгоос суллагдсан бөгөөд түүний гайхалтай таамаглал нь зөвхөн 1907 онд ганцаарчлан бичсэн "Материйн бүтцийн үечилсэн систем" ном хэвлэгдсэний дараа л мэдэгдэв.
1926 онд Н.А. Морозов ЗХУ-ын ШУА-ийн хүндэт гишүүнээр сонгогдов.
Удаан хугацааны туршид үнэт хийн атомууд бусад элементүүдийн атомуудтай химийн холбоо үүсгэх чадваргүй гэж үздэг байв. Зөвхөн харьцангуй тогтворгүй сайхан хийн молекулын нэгдлүүдийг л мэддэг байсан - жишээлбэл, хэт хөргөсөн усыг талстжуулахад шахсан үнэт хийн үйлчлэлээр үүссэн гидратууд. Эдгээр гидратууд нь клатратын төрөлд хамаарна (§ 72-ыг үзнэ үү); Ийм нэгдэл үүсэхэд валентын холбоо үүсдэггүй.
Мөсний талст бүтцэд олон тооны хөндий байгаа нь устай клатрат үүсэхэд таатай байдаг (§ 70-ыг үзнэ үү).
Гэсэн хэдий ч сүүлийн хэдэн арван жилд криптон, ксенон, радон нь бусад элементүүд, юуны түрүүнд фтортой нэгдэх чадвартай болох нь тогтоогдсон. Тиймээс, үнэт хий нь фтортой шууд харилцан үйлчлэлцэх замаар (халаах эсвэл цахилгаан цэнэгийн үед) фторыг олж авдаг. Эдгээр нь бүгд хэвийн нөхцөлд тогтвортой байдаг талстууд юм. Ксенон деривативуудыг мөн исэлдэлтийн хэмжээгээр олж авсан - гексафторид, триоксид, гидроксид. Сүүлийн хоёр нэгдэл нь хүчиллэг шинж чанарыг харуулдаг; Тиймээс шүлтүүдтэй урвалд орж ксеноны хүчлийн давс үүсгэдэг, жишээлбэл:.
Царегородцев Александр
Эрхэм хийн нэгдлүүд нь органик болон органик бус химийн хамгийн сонирхолтой сэдвүүдийн нэг бөгөөд тэдгээрийн нэгдлүүдийн шинж чанарыг олж илрүүлэх нь 20-р зууны бүх эрдэмтдийн санаа бодлыг орвонгоор нь эргүүлсэн, учир нь тэр үед ийм бодис оршин тогтнох боломжгүй гэж үздэг байв. , одоо үүнийг аль хэдийн тайлбарласан хэвийн зүйл гэж ойлгодог.
Ксенон бол бусад химийн бодисуудтай холбоо тогтооход хамгийн хялбар үнэт хий юм. Хүн төрөлхтөн түүний нэгдлүүдийг ашигласан бөгөөд бидний амьдралд аль хэдийн хэрэглэгдэж байна.
Үзүүлсэн бүтээл нь энэ сэдвээр олон нийтийн сонирхлыг төрүүлж магадгүй юм.
Татаж авах:
Урьдчилан үзэх:
Хотын автономит ерөнхий боловсролын байгууллага
"Хими, биологийн гүнзгийрүүлсэн сургалттай 5-р дунд сургууль"
хүрээнд боловсролын судалгааны ажил
В Менделеевийн уншлага
Сэдэв: Эрхэм хийн нэгдлүүд
Гүйцэтгэсэн: Царегородцев
Александр, 9-р ангийн сурагч
Удирдагч: Григорьева
Наталья Геннадьевна, химийн багш
Старая Русса
2017
Оршил
Инерцийн хий нь VIII-a бүлэгт багтдаг металл бус хий юм. Тэдгээрийг 19-р зууны төгсгөлд нээсэн бөгөөд үечилсэн системд илүүдэл гэж үздэг байсан ч үнэт хий нь түүний байр суурийг эзэлдэг.
Сүүлийн эрчим хүчний түвшинг дүүргэсэн тул удаан хугацааны туршид эдгээр бодисууд бонд үүсгэж чадахгүй гэж үздэг байсан. мөн тэдгээрийн молекулын нэгдлүүдийг нээсний дараа олон эрдэмтэд цочирдож, тэр үед байсан химийн хуулиудад захирагдаж чадаагүй тул итгэж чадахгүй байв.
Эрхэм хийн нэгдлүүдийг үүсгэх амжилтгүй оролдлого нь эрдэмтдийн урам зоригт сөргөөр нөлөөлсөн боловч энэ нь энэ салбарыг хөгжүүлэхэд саад болоогүй юм.
Би бүтээлээ толилуулж буй үзэгчдийн сонирхлыг татахыг хичээх болно.
Миний ажлын зорилго: органик бус ксенон нэгдлүүдийн үүссэн түүх, шинж чанарыг судлах.
Даалгаварууд:
1. Үнэт хийн нэгдлүүдийн үйлдвэрлэлийн түүхтэй танилцах
2. Фтор ба хүчилтөрөгчийн нэгдлүүдийн шинж чанаруудтай танилцах
3. Миний ажлын үр дүнг оюутнуудад хүргэх
Түүхийн лавлагаа
Ксеноныг 1898 онд нээсэн бөгөөд хэдхэн жилийн дараа түүний гидратыг олж авсан ба ксенон, криптоныг бүгдийг нь клатрат гэж нэрлэдэг байв.
1916 онд Кессел инертийн хийн иончлолын зэрэгт үндэслэн тэдгээрийн шууд химийн нэгдлүүд үүсэхийг урьдчилан таамаглаж байв.
20-р зууны 1-р улирлын ихэнх эрдэмтэд үнэт хий нь үечилсэн системийн тэг бүлэгт багтдаг бөгөөд 0 валенттай гэж үздэг байсан ч 1924 онд А.фон Антропов бусад химичүүдийн санал бодлыг сөрж эдгээр элементүүдийг . найм дахь бүлэг, үүнээс үүдэн тэдгээрийн нэгдлүүдийн хамгийн өндөр валент нь 8. Тэрээр мөн тэд галоген, өөрөөр хэлбэл VII-a бүлгийн металл бусуудтай холбоо үүсгэх ёстой гэж таамаглаж байсан.
1933 онд Паулинг криптон ба ксеноны боломжит нэгдлүүдийн томъёог урьдчилан таамаглаж байсан: тогтвортой криптон ба ксенон гексафторид (KrF 6 ба XeF 6). ), тогтворгүй ксенон октафторид (XeF 8
) ба ксеноны хүчил (H 4 Xeo 6 ). Мөн онд Г.Оддо цахилгаан гүйдэл дамжуулж ксенон, фторыг нийлэгжүүлэх гэж оролдсон боловч энэ урвал явагдсан савны зэврэлтээс үүссэн бодисыг цэвэрлэж чадаагүй юм. Тэр мөчөөс эхлэн эрдэмтэд энэ сэдвийг сонирхохоо больсон бөгөөд 60-аад он хүртэл бараг хэн ч үүнтэй холбоогүй байв.
Их Британийн эрдэмтэн Нейл Бартлеттын диоксигенил гексафтороплатинат (O) нийлэгжүүлэлтээс үнэт хийн нэгдлүүд байж болохыг шууд нотолж байна. 2). Платинум гексафторид нь бэлэвсэн эмэгтэйн исэлдүүлэх чадвар нь фтороос илүү байдаг. 1962 оны 3-р сарын 23-нд Нейл Бартлетт ксенон ба цагаан алтны гексафторидыг нийлэгжүүлж, хүссэн зүйлээ олж авав: оршин тогтнож буй анхны үнэт хийн нэгдэл болох шар өнгийн хатуу Xe. Үүний дараагаар тухайн үеийн эрдэмтдийн бүх хүчийг ксенон фторын нэгдлүүдийг бий болгоход зарцуулав.
Ксенон фторын нэгдлүүд ба тэдгээрийн шинж чанарууд
Эхний молекулын нэгдэл нь XePtF томьёотой ксенон гексафторидеплатинат байв 6 . Энэ нь цул, гадна талдаа шар, дотор талд нь тоосгон улаан; 115°С хүртэл халаахад шилэн хэлбэртэй болж, 165°С хүртэл халаахад XeF ялгарснаар задарч эхэлдэг. 4 .
Үүнийг мөн ксенон ба фторын хэт ислийг урвалд оруулах замаар олж авч болно.
Мөн өндөр температур, даралтын дор ксенон ба хүчилтөрөгчийн фторидын харилцан үйлчлэлийн үед:
XeF2 нь усанд уусдаг өнгөгүй талст юм. Уусмалын хувьд энэ нь маш хүчтэй исэлдүүлэх шинж чанарыг харуулдаг боловч тэдгээр нь фторын чадвараас хэтрэхгүй байна. Хамгийн хүчтэй холболт.
1. Шүлттэй харилцан үйлчлэхэд ксенон сэргээгддэг.
2. Устөрөгчтэй харилцан үйлчлэлцснээр та энэхүү фтороос ксеноныг сэргээж болно.
3. Ксенон дифторидыг сублимацияд оруулахад ксенон тетрафторид ба ксенон өөрөө гарна.
Ксенон (IV) фтор XeF4Дифторидтой ижил аргаар олж авсан боловч 400 хэмийн температурт:
XEF 4 - Эдгээр нь цагаан талстууд бөгөөд энэ нь хүчтэй исэлдүүлэгч бодис юм. Энэ бодисын шинж чанарын талаар дараахь зүйлийг хэлж болно.
1. Энэ нь хүчтэй фторжуулагч бодис бөгөөд өөрөөр хэлбэл бусад бодисуудтай харьцахдаа фторын молекулуудыг тэдгээрт шилжүүлэх чадвартай:
2. Устай харилцан үйлчлэхэд ксенон тетрафторид нь ксенон исэл (III) үүсгэдэг:
3. Устөрөгчтэй харилцан үйлчлэх үед ксенон болж сэргэнэ:
Xenon (VI) фторын XeF 6 илүү өндөр температур, өндөр даралтанд үүссэн:
XEF 6 тэдгээр нь цайвар ногоон өнгөтэй талстууд бөгөөд хүчтэй исэлдүүлэх шинж чанартай байдаг.
1. Ксенон (IV) фторын нэгэн адил фторжуулагч бодис юм.
2. Гидролиз нь ксеноны хүчил үүсгэдэг
Ксеноны хүчилтөрөгчийн нэгдлүүд ба тэдгээрийн шинж чанарууд
Ксенон (III) оксид XeO 3
- энэ нь цагаан өнгөтэй, дэгдэмхий бус, тэсрэх бодис бөгөөд усанд маш сайн уусдаг. Үүнийг ксенон (IV) фторын гидролизийн аргаар олж авдаг.
1. Шүлтлэг уусмалд озоны нөлөөгөөр ксеноны хүчлийн давс үүсгэдэг бөгөөд ксенон нь исэлдэлтийн түвшин +8 байна.
2. Ксенон давс нь төвлөрсөн хүхрийн хүчилтэй харилцан үйлчлэхэд энэ нь үүсдэгксенон (IV) исэл:
Xeo 4 -36 хэмээс доош температурт шар талстууд, түүнээс дээш температурт - 0 хэмийн температурт задардаг өнгөгүй тэсрэх бодис:
Үүний үр дүнд ксенон фторидууд нь усанд уусдаг цагаан эсвэл өнгөгүй талстууд, хүчтэй исэлдүүлэх шинж чанартай, химийн идэвхжилтэй, ислүүд нь дулааны энергийг амархан ялгаруулж, улмаар тэсрэх аюултай байдаг.
Хэрэглээ ба боломж
Тэдний шинж чанараас шалтгаалан ксенон нэгдлүүдийг ашиглаж болно:
- Пуужингийн түлш үйлдвэрлэх зориулалттай
- Эм, эмнэлгийн тоног төхөөрөмж үйлдвэрлэх зориулалттай
- Тэсрэх бодис үйлдвэрлэх зориулалттай
- Органик болон органик бус химийн хүчтэй исэлдүүлэгч бодисууд
- Реактив фторыг тээвэрлэх арга болгон
Дүгнэлт
Эрхэм хийн нэгдлүүд нь органик болон органик бус химийн хамгийн сонирхолтой сэдвүүдийн нэг бөгөөд тэдгээрийн нэгдлүүдийн шинж чанарыг олж илрүүлэх нь 20-р зууны бүх эрдэмтдийн санаа бодлыг орвонгоор нь эргүүлсэн, учир нь тэр үед ийм бодис оршин тогтнох боломжгүй гэж үздэг байв. , одоо үүнийг аль хэдийн тайлбарласан хэвийн зүйл гэж ойлгодог.
Ксенон бол бусад химийн бодисуудтай холбоо тогтооход хамгийн хялбар үнэт хий юм. Хүн төрөлхтөн түүний нэгдлүүдийг ашигласан бөгөөд бидний амьдралд аль хэдийн хэрэглэгдэж байна.
Би судалгааныхаа зорилгодоо бүрэн хүрсэн гэж бодож байна: Би сэдвийг аль болох үнэн зөв нээсэн, ажлын агуулга нь түүний сэдэвтэй бүрэн нийцэж байгаа, органик бус ксенон нэгдлүүдийн үүссэн түүх, шинж чанарыг судалсан.
Ном зүй
1. Кузьменко Н.Е.“Химийн богино курс. Их дээд сургуульд элсэгчдэд зориулсан гарын авлага ”/ / Дээд сургуулийн хэвлэлийн газар, 2002, 267-р тал.
2. Пушленков М.Ф.“Эрхэм хийн нэгдлүүд”//Атомиздат, 1965
3. Fremantle M. "Хими үйл ажиллагаа" 2-р хэсэг // Мир хэвлэлийн газар, 1998, 290-291 хуудас.
4. Интернетийн эх сурвалж
http://him.1september.ru/article.php?ID=200701901
http://rudocs.exdat.com/docs/index-160337.html
https://en.wikipedia.org/wiki/Xenon_fluoride(II)
https://ru.wikipedia.org/wiki/Xenon_fluoride(IV)
https://en.wikipedia.org/wiki/Xenon_fluoride(VI)
http://edu.sernam.ru/book_act_chem2.php?id=96
http://chemistry.ru/course/content/chapter8/section/paragraph2/subparagraph7.html#.WLMQ5FPyjGg
Урьдчилан үзэх:
Үзүүлэнг урьдчилан үзэхийг ашиглахын тулд Google акаунт (бүртгэл) үүсгэн нэвтэрнэ үү: https://accounts.google.com
Слайдын тайлбар:
Сайн хийн фтор ба хүчилтөрөгчийн нэгдлүүд. Ксенон нэгдлүүд Гүйцэтгэсэн: Царегородцев Александр, 5-р дунд сургуулийн 9-р ангийн сурагч Дарга: Химийн багш Григорьева Наталья Геннадьевна
Оршил Инерцийн хий нь VIII бүлэгт багтдаг металл бус хий юм. Тэдгээрийг 19-р зууны төгсгөлд нээсэн бөгөөд үечилсэн системд илүүдэл гэж үздэг байсан ч үнэт хий нь түүний байр суурийг эзэлдэг. Сүүлийн энергийн түвшинг дүүргэсэн тул эдгээр бодисууд нь холбоо үүсгэж чадахгүй гэж удаан хугацааны туршид итгэдэг байсан бөгөөд тэдгээрийн молекулын нэгдлүүдийг нээсний дараа олон эрдэмтэд цочирдож, хуулинд захирагдахгүй байсан тул үүнд итгэж чадахгүй байв. тухайн үед байсан химийн . Эрхэм хийн нэгдлүүдийг үүсгэх амжилтгүй оролдлого нь эрдэмтдийн урам зоригт сөргөөр нөлөөлсөн боловч энэ нь энэ салбарыг хөгжүүлэхэд саад болоогүй юм. Би бүтээлээ толилуулж буй үзэгчдийн сонирхлыг татахыг хичээх болно.
Зорилго, зорилт Ажлын зорилго: Органик бус ксенон нэгдлүүдийн үүсэх түүх, шинж чанарыг судлах. Зорилго: 1. Үнэт хийн нэгдлүүдийг олж авсан түүхтэй танилцах 2. Эдгээр нэгдлүүд яагаад үүсэх боломжтой болохыг ойлгох 3. Фтор ба хүчилтөрөгчийн нэгдлүүдийн шинж чанаруудтай танилцах 4. Ажлынхаа үр дүнг үе тэнгийнхэнд хүргэх.
Бүтээлийн түүх Эдгээр нэгдлүүдийг олж авах гэсэн бүх оролдлого бүтэлгүйтсэн тул эрдэмтэд тэдгээрийн томъёо, ойролцоо шинж чанарууд нь ямар байхыг таамаглаж байв. Энэ салбарт хамгийн үр бүтээлтэй химич бол Нейл Бартлетт байв. Түүний гол гавьяа бол ксенон гексафтороплатинат Xe [PtF 6] бэлтгэх явдал юм.
Ксенон фторууд Ксенон (II) фтор Ксенон (IV) фтор Ксенон (VI) фтор
Ксенон исэл Ксенон (VI) исэл Ксенон (VIII) исэл ТЭСЭРГЭГЧ!!!
Ксенон нэгдлүүдийг ашиглах Пуужингийн түлш үйлдвэрлэхэд Эм, эмнэлгийн хэрэгсэл үйлдвэрлэхэд Тэсрэх бодис үйлдвэрлэхэд Фторыг тээвэрлэх арга Органик болон органик бус химийн исэлдүүлэгч бодис болгон.
Дүгнэлт Эрхэм хийн нэгдлүүд нь органик ба органик бус химийн хамгийн сонирхолтой сэдвүүдийн нэг бөгөөд тэдгээрийн нэгдлүүдийн шинж чанарыг нээсэн нь 20-р зууны бүх эрдэмтдийн үзэл бодлыг орвонгоор нь эргүүлсэн, учир нь тэр үед ийм бодис байдаг гэж үздэг байв. боломжгүй, одоо үүнийг аль хэдийн тайлбарласан хэвийн зүйл гэж үздэг.
Анхаарал тавьсанд баярлалаа!
Эрдэмтэд удаан хугацааны туршид үнэт хий нь валентийн электрон агуулсан электрон бүрхүүлд илүү их электрон багтаамжгүй тул нэгдэл үүсгэж чадахгүй гэж үздэг. Энэ нь тэд илүү их электрон хүлээн авах боломжгүй, химийн холбоог боломжгүй болгодог гэсэн үг юм. Гэсэн хэдий ч 1933 онд Линус Паулинг хүнд язгуур хий нь хамгийн өндөр цахилгаан сөрөг нөлөөтэй атомуудтай тул фтор эсвэл хүчилтөрөгчтэй урвалд орж болно гэж үзсэн. Түүний таамаг зөв болж, дараа нь үнэт хийн нэгдлүүдийг олж авсан.
Энэхүү үнэт хийн нэгдлийг анх Канадын химич Нейл Бартлетт 1962 онд цагаан алтны гексафторидыг ксенонтой урвалд оруулах замаар гаргаж авсан. Энэ нэгдлийг XePtF 6 томъёогоор өгсөн (дараа нь буруу байсан ]). Бартлетийн илтгэлийн дараа тэр жилдээ энгийн ксенон фторидыг олж авсан. Тэр цагаас хойш үнэт хийн хими идэвхтэй хөгжиж ирсэн.
Холболтын төрлүүд
Холболтуудыг идэвхжүүлнэ үү
Болор эсвэл химийн торонд агуулагдах үнэт хийн нэгдлүүдийг химийн холбоо үүсгэхгүйгээр орлуулах нэгдлүүд гэж нэрлэдэг. Эдгээрт жишээлбэл, инертийн хийн гидратууд, хлороформтой инертийн хийн клатратууд, фенолууд гэх мэт орно.
Мөн язгууртны хий нь фуллерений молекулын дотор талд эрхэм хийн атомыг "түлхэх" үед эндоэдр фуллерентэй нэгдлүүд үүсгэж болно.
Нарийн төвөгтэй нэгдлүүд
Саяхан (2000) ксенон нь алттай (жишээ нь (Sb 2 F 11) 2) нийлмэл болж, лиганд болж чаддаг болохыг харуулсан. Мөн ксенон дифторид нь лигандын үүрэг гүйцэтгэдэг цогц нэгдлүүдийг олж авсан.
Химийн нэгдлүүд
Сүүлийн жилүүдэд үнэт хийн хэдэн зуун химийн нэгдлүүдийг (өөрөөр хэлбэл дор хаяж нэг сайн хий-элементийн холбоо) олж авсан. Эдгээр нь ихэвчлэн ксеноны нэгдлүүд юм, учир нь хөнгөн хий нь илүү идэвхгүй, радон нь ихээхэн цацраг идэвхт шинж чанартай байдаг. Криптоны хувьд арав гаруй нэгдлүүдийг мэддэг (гол төлөв криптон дифторидын цогцолборууд), радоны хувьд үл мэдэгдэх найрлагатай фторыг мэддэг. Криптоноос хөнгөн хийнүүдийн хувьд зөвхөн хатуу идэвхгүй хийн матриц дахь нэгдлүүд (жишээлбэл, HArF) нь криоген температурт задардаг гэдгийг мэддэг.
Ксеноны хувьд нэгдлүүд нь Xe-F, Xe-O, Xe-N, Xe-B, Xe-C, Xe-Cl холбоо байгаа газруудад мэдэгддэг. Бараг бүгдээрээ нэг градус хүртэл фторжуулж, халах үед задардаг.
Холбоосууд
- Хриаччев, Леонид; Расанен, Маркку; Гербер, Р.Бенни.Эрхэмсэг хийн гидридүүд: Бага температурт шинэ хими // Химийн судалгааны бүртгэл (Англи)орос: өдрийн тэмдэглэл. - 2009. - Боть. 42, үгүй. нэг . - P. 183. -
Химийн шинжлэх ухааны доктор В.И.Фельдман
"Инерцийн хийн хими" гэсэн хэллэг нь парадоксик сонсогдож байна. Үнэн хэрэгтээ, хэрэв бүх электрон бүрхүүлүүд нь атомуудаар дүүрсэн тул ямар нэгэн зүйлтэй харьцах ёсгүй бол идэвхгүй бодис ямар химийн шинж чанартай байж болох вэ? Гэсэн хэдий ч 20-р зууны хоёрдугаар хагаст химичүүд дүүрсэн бүрхүүлийн хамгаалалтыг даван туулж, идэвхгүй хийн органик бус нэгдлүүдийг нэгтгэж чаджээ. Мөн 21-р зуунд Орос, Финландын эрдэмтэд зөвхөн инертийн хий, нүүрстөрөгч, устөрөгчийн атомуудаас бүрдэх бодисыг олж авсан.
Энэ бүхэн фтороос эхэлсэн
Чухамдаа хүчтэй исэлдүүлэгч бодис бүхий криптон, ксенон, радоны химийн нэгдлүүд байж магадгүй гэж Линус Паулинг 1933 онд дурдсан байдаг. Гэсэн хэдий ч 1962 онд Нейл Бартлетт эдгээр нэгдлүүдийн эхнийх нь болох XePtF 6-г Канадад нийлэгжүүлэхэд гуч орчим жил зарцуулсан бол урвалд үнэт хий, хүчтэй исэлдүүлэгч бодис болох платин гексафторид оролцсон. Эрдэмтний эрэл хайгуул хийхдээ тулгуурласан бодол нь химич бүрт маш энгийн бөгөөд ойлгомжтой байсан: хэрэв цагаан алтны гексафторид нь молекулын хүчилтөрөгчөөс ч электрон авдаг тийм хүчтэй бол яагаад үүнийг ксеноноор хийж болохгүй гэж? Эцсийн эцэст, энэ хийн атомын гаднах электрон нь цөмд хүчилтөрөгчийнхээс илүү хүчтэй наалддаг - энэ нь иончлолын потенциалын бараг ижил утгуудаар нотлогддог. Амжилттай нийлэгжсэний дараа таамаглал батлагдсаны дараа хүчтэй исэлдүүлэгч бодис бүхий ксенон нэгдлүүдийн бүхэл бүтэн гэр бүлийг олж авсан - фторид, оксифторид, исэл, ксеноны хүчлийн давс, олон тооны цогцолборууд. Химичид мөн Xe-B ба Xe-N холбоо бүхий ксенон хлорид ба фтор агуулсан нэгдлүүдийг нэгтгэсэн.
Дараагийн хорин жилд ксенон хими ба органик химийн огтлолцол дээр сонирхолтой үйл явдлууд өрнөв. Далаад онд тогтворгүй молекул FXeCF 3, дараа нь Xe (CF 3) 2-ын нийлэгжилтийн тухай тайлан гарч ирэв. Наяад оны сүүлээр катион нь Xe-C холбоо (бор) агуулсан аль хэдийн тогтвортой ионы давсыг олж авсан. фтор нь дүрмээр бол анионы үүрэг гүйцэтгэдэг). Энэ төрлийн нэгдлүүдийн дунд онцгой анхаарал татдаг (яагаад - энэ нь дараа нь тодорхой болно) V.V-ийн нийлэгжүүлсэн алкинилксенониум - + - давс юм. Жданкин, П.Станг, Н.С. Зефиров 1992 онд. Үнэн хэрэгтээ ийм нэгдлүүдийг органик болон органик бус гэж үзэж болох ч ямар ч тохиолдолд тэдгээрийг бэлтгэх нь онолын болон синтетик химийн аль алинд нь том алхам болсон юм.
Криптон бууж өгөхөд илүү хэцүү байсан. Гэсэн хэдий ч эхлээд фтортой нэгтгэж, дараа нь илүү нарийн төвөгтэй молекулуудад нэгтгэх боломжтой байв.
Эдгээр бүх нэгдлүүд нь ямар нэгэн инээдтэй чамин зүйл гэж бодох шаардлагагүй. Тэдгээрийн дор хаяж нэг анги болох ксенон фторидууд ба юуны түрүүнд түүний дифторид нь лабораторийн туршилтанд ямар нэг зүйлийг фторжуулах шаардлагатай бол ихэвчлэн ашиглагддаг. Тэд мөн ашигт малтмалын түүхий эдийг нээх, мэдээжийн хэрэг, шинэ ксеноны деривативуудын нийлэгжилтэнд завсрын нэгдлүүдийн үүрэг гүйцэтгэдэг.
Ерөнхийдөө инертийн хийн химийн "Бартлеттиан" чиг хандлага нь хоёр үндсэн шинж чанартай байдаг. Нэгдүгээрт, энэ нь ионы химийн ангилалд хамаарна. Тэгэхээр анхны ксеноны нэгдлийн томьёог Xe + - гэж бичих нь илүү зөв юм. Бүх тохиолдолд инертийн хий нь бууруулагч бодис болдог. Энэ нь хамгийн ерөнхий ойлголтоос ойлгомжтой юм: бүх хүслээр дүүрсэн электрон бүрхүүлтэй атом дахин нэг электрон хүлээн авах боломжгүй, гэхдээ үүнийг өгч чадна. Хамгийн гол нь түнш нь түрэмгий, тууштай байх ёстой, өөрөөр хэлбэл исэлдүүлэх шинж чанартай байх ёстой. Ксенон нь "октет язгууртнуудтай" бусдаас илүү амархан салсан нь гайхах зүйл биш юм: түүний гаднах бүрхүүлийн электронууд нь цөмөөс хол байрладаг бөгөөд сул байдаг.
Хоёрдугаарт, инерт хийн орчин үеийн хими нь фторын химитэй нягт холбоотой. Нэгдлүүдийн дийлэнх нь фторын атом агуулдаг бөгөөд фтор байхгүй ховор тохиолдолд ч тэдгээрийг олж авах зам нь фтороор дамждаг.
Өөрөөр байж болох уу? Зөвхөн фторгүй төдийгүй бусад исэлдүүлэгчгүй инерт хийн нэгдлүүд байдаг уу? Жишээлбэл, саармаг тогтвортой молекулуудын хэлбэрээр, инертийн хийн атом нь устөрөгчтэй холбогддог бөгөөд өөр юу ч биш үү? Саяхныг хүртэл ийм асуулт онолчид, туршилтчдын аль алинд нь ч төрөөгүй бололтой. Үүний зэрэгцээ, яг эдгээр молекулуудын талаар цаашид хэлэлцэх болно.
Язгууртны үүргийн тухай уянгын ухралт
Инерцийн хийн гидридийн тухай ярихаасаа өмнө хамгийн эхэнд, тухайлбал, үнэт хийн идэвхгүй байдал руу буцъя. Дээр дурдсан бүх зүйлийг үл харгалзан наймдугаар бүлгийн үндсэн дэд бүлгийн элементүүд нь тэдний бүлгийн нэрийг бүрэн зөвтгөдөг. Мөн хүн албадан реактив байдлыг бус харин байгалийн идэвхгүй байдлыг ашигладаг.
Жишээлбэл, физик химичүүд энэ аргыг ашиглах дуртай: инертийн хийн хольцыг зарим бодисын молекулуудтай хөлдөөх. 4-20 К-ийн температурт хөргөсний дараа эдгээр молекулууд нь хатуу идэвхгүй хийн матрицад тусгаарлагддаг. Дараа нь та гэрлийн эсвэл ионжуулагч цацрагаар ажиллаж, ямар төрлийн завсрын хэсгүүдийг олж авахыг харж болно. Бусад нөхцөлд ийм тоосонцор харагдахгүй: тэд хэтэрхий хурдан хариу үйлдэл үзүүлдэг. Олон жилийн турш итгэсэн инерт хийтэй бол хариу үйлдэл үзүүлэхэд маш хэцүү байдаг. Олон жилийн турш ийм судалгааг манай лабораториудад - А.И. Л.Я. Карпов, дараа нь ОХУ-ын Шинжлэх ухааны академийн Синтетик полимер материалын хүрээлэнд хийсэн судалгааны үр дүнд янз бүрийн физик шинж чанартай матрицуудыг (аргон, криптон, ксенон) ашиглах нь хүрээлэн буй орчны нөлөөллийн талаар олон шинэ, сонирхолтой зүйлийг олж илрүүлэв. тусгаарлагдсан молекулуудын цацраг-химийн хувиргалт. Гэхдээ энэ бол тусдаа өгүүллийн сэдэв юм. Манай түүхийн хувьд матрицын ийм тусгаарлалт нь хүн бүрийн хувьд гэнэтийн байдлаар инерт хийн химийн цоо шинэ талбарт хүргэсэн нь чухал юм. Энэ нь 1995 онд АНУ-д болсон матрицыг тусгаарлах олон улсын бага хурлын үеэр болсон нэг уулзалтын үр дүнд болсон юм. Тэр үед шинжлэх ухааны ертөнц ксенон ба криптоны шинэ ер бусын нэгдлүүд байгаа талаар анх мэдсэн.
Гидридүүд тайзан дээр гардаг
Хельсинкийн их сургуулийн Финляндын химич Мика Петтерсон, Ян Лунделл, Маркку Расанен нар идэвхгүй хийн хатуу матрицыг галоген устөрөгчөөр (HCl, HBr, HI) дүүргэж, гэрлийн нөлөөн дор эдгээр бодис хэрхэн задарч байгааг ажиглав. Хэрэв 20 К-ээс доош температурт хийгдсэн лазер фотолизийн дараа ксенон матрицыг 50 К хүртэл халаавал 2000-аас 1000 см-ийн хоорондох IR спектрт шинэ, маш хүчтэй шингээлтийн зурвасууд гарч ирдэг. -1. (Сонгодог чичиргээний спектроскопийн хувьд "дунд" ба "алс" IR мужид долгионы тоонуудын хуваарийг уламжлалт байдлаар ашигладаг - чичиргээний давтамжийн эквивалентыг харилцан сантиметрээр илэрхийлдэг. Чухам ийм хэлбэрээр чичиргээний спектрийн шинж чанарыг өгдөг. бараг бүх сурах бичиг, лавлах ном, өгүүлэлд. ) Криптон матрицад 30 К хүртэл халаасны дараа ижил нөлөө илэрч байсан бол аргон матрицад шинэ зурвас ажиглагдаагүй.
Хельсинкийн судлаачид зоримог таамаг дэвшүүлэв: шингээлт нь H-Xe болон H-Kr бондын суналтын чичиргээнээс үүдэлтэй. Өөрөөр хэлбэл, цацрагийн дээжийг халаахад инертийн хийн атом агуулсан шинэ молекулууд гарч ирдэг. Изотопыг орлуулах, квант химийн тооцоолол хийх туршилтууд энэ таамаглалыг бүрэн баталжээ. Ийнхүү инертийн хийн нэгдлүүдийн гэр бүлийг маш ер бусын төрлийн хэд хэдэн шинэ гишүүд - HXeCl, HXeBr, HXeI, HKrCl, HXeH -ээр нэг дор дүүргэв. Эдгээр томъёоны сүүлчийнх нь сонгодог уламжлалаар хүмүүжсэн химичдэд онцгой хүчтэй сэтгэгдэл төрүүлсэн: зөвхөн ксенон ба устөрөгч, хүчтэй исэлдүүлэгч бодис байхгүй!
Дэлхийн химийн газрын зураг дээр шинэ нэгдэл гарч ирэхийн тулд түүнийг өвөрмөц байдлаар тодорхойлох ёстой гэдгийг энд тэмдэглэх нь зүйтэй. Расанен болон түүний хамтрагчид нүдэндээ итгэж зүрхэлж, зоригтой таамаг дэвшүүлж, үүнийг баталж чадсан юм. Үүний зэрэгцээ бусад эрдэмтэд идэвхгүй матрицтай ижил төстэй туршилтуудыг хийжээ. Тэд ксенон ба криптон гидридийн шингээлтийн зурвасыг ажигласан байх магадлалтай боловч тэдгээрийг тодорхойлж чадаагүй байна. Ямар ч тохиолдолд ксенон дигидридийг бидний туршилтаар олж авсан нь эргэлзээгүй, зөвхөн бид үүнийг сэжиглээгүй. Гэхдээ Хельсинкийн бүлгийн шуугиан тарьсан мэдээллийг анх удаа танилцуулсан хурал дээр Финляндын хамт олонтойгоо бидний байр суурийг судалж байхдаа бид энэ холбоог шууд олж мэдсэн. Финляндын хамт ажиллагсдаас ялгаатай нь бид нүүрсустөрөгчийг ксеноноор хөлдөөж, дараа нь хурдан электроноор цацруулсан. Гидрид нь 40 К хүртэл халаахад үүссэн.
Халаалтын явцад инертийн хийн шинэ, ер бусын нэгдэл үүсэх нь: энэ нь хоёрдогч урвалын тухай юм. Гэхдээ тэдгээрт ямар хэсгүүд оролцдог вэ? Эхний туршилтууд энэ асуултын хариуг өгөөгүй.
Хийн мөс дэх метастабил бонд
Ксенон химийн "ионы уламжлал" -ын дагуу Финландын судлаачид ионы тоосонцор, протон ба холбогдох анионууд нь энд урьдал шинж чанартай байдаг. Зөвхөн IR спектроскопийн өгөгдөлд тулгуурлан энэ таамаглалыг баталгаажуулах боломжгүй байсан, учир нь халаах явцад спектрийн зурвасууд гэнэт, юу ч биш юм шиг гарч ирэв. Гэсэн хэдий ч бидний мэдэлд электрон парамагнит резонансын арга (EPR) байсан. Түүний тусламжтайгаар цацрагийн үед ямар төрлийн атом, радикалууд гарч ирдэг, тэдгээр нь хэр хурдан арилдагийг тодорхойлох боломжтой. Ялангуяа ксенон матриц дахь устөрөгчийн атомууд нь маш сайн EPR дохио өгдөг бөгөөд хосгүй электрон нь ксенон изотопуудын соронзон цөмүүдтэй (129Xe ба 131Xe) харилцан үйлчлэлийн онцлог шинж чанартай байдаг тул үүнийг юугаар ч андуурч болохгүй.
Эрчим хүчний цооног дахь устөрөгчийн атомуудын тэнүүчлэл нь иймэрхүү харагдаж байна: HY молекултай харгалзах дэлхийн хамгийн бага хэмжээ нь хамаагүй бага боловч хоёр төлөвийн хоорондох саад нь идэвхгүй бодис агуулсан завсрын нэгдлийн харьцангуй тогтвортой байдлыг хангахуйц хангалттай том байна. хий.