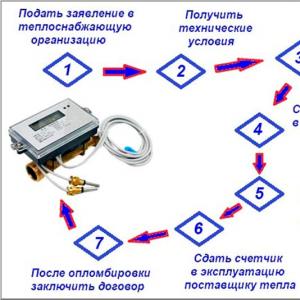
රසායන විද්යාවේ ශක්ති මට්ටම් ලියන්නේ කෙසේද? ශක්ති මට්ටම්, උප මට්ටම් සහ කක්ෂ. ලැබුණු ද්රව්ය සමඟ අපි කුමක් කරමුද?
ඉලෙක්ට්රොනික වින්යාසයපරමාණුවක් යනු එහි ඉලෙක්ට්රෝන කක්ෂවල සංඛ්යාත්මක නිරූපණයකි. ඉලෙක්ට්රෝන කක්ෂ යනු පරමාණුක න්යෂ්ටිය වටා පිහිටා ඇති විවිධ හැඩයන්ගෙන් යුත් කලාප වන අතර, ඉලෙක්ට්රෝනයක් සොයා ගැනීමට ගණිතමය වශයෙන් සම්භාවිතාව ඇත. ඉලෙක්ට්රොනික වින්යාසය පරමාණුවක ඉලෙක්ට්රෝන කක්ෂ කීයක් තිබේද යන්න ඉක්මනින් සහ පහසුවෙන් පාඨකයාට පැවසීමට මෙන්ම එක් එක් කාක්ෂිකයේ ඇති ඉලෙක්ට්රෝන ගණන තීරණය කිරීමට උපකාරී වේ. මෙම ලිපිය කියවීමෙන් පසු, ඔබ ඉලෙක්ට්රොනික සැකසුම් සම්පාදනය කිරීමේ ක්රමය ප්රගුණ කරනු ඇත.
පියවර
D. I. Mendeleev හි ආවර්තිතා පද්ධතිය භාවිතයෙන් ඉලෙක්ට්රෝන බෙදා හැරීම
- උදාහරණයක් ලෙස, -1 ආරෝපණයක් සහිත සෝඩියම් පරමාණුවක අමතර ඉලෙක්ට්රෝනයක් ඇත අතිරෙකවඑහි පාදම පරමාණුක ක්රමාංකය 11. වෙනත් වචන වලින් කිවහොත්, පරමාණුවක මුළු ඉලෙක්ට්රෝන 12 ක් ඇත.
- අපි කතා කරන්නේ +1 ආරෝපණයක් සහිත සෝඩියම් පරමාණුවක් ගැන නම්, එක් ඉලෙක්ට්රෝනයක් පාදක පරමාණුක අංක 11 න් අඩු කළ යුතුය. එබැවින් පරමාණුවේ ඉලෙක්ට්රෝන 10 ක් ඇත.
-
කක්ෂවල මූලික ලැයිස්තුව මතක තබා ගන්න.පරමාණුවක ඉලෙක්ට්රෝන සංඛ්යාව වැඩි වන විට, ඒවා යම් අනුපිළිවෙලකට අනුව පරමාණුවේ ඉලෙක්ට්රෝන කවචයේ විවිධ උප මට්ටම් පුරවයි. ඉලෙක්ට්රෝන කවචයේ එක් එක් උප මට්ටමේ, පිරවූ විට, ඉරට්ටේ ඉලෙක්ට්රෝන සංඛ්යාවක් අඩංගු වේ. පහත උප මට්ටම් ඇත:
විද්යුත් වින්යාස වාර්තාව තේරුම් ගන්න.එක් එක් කක්ෂයේ ඇති ඉලෙක්ට්රෝන සංඛ්යාව පැහැදිලිව පිළිබිඹු කිරීම සඳහා ඉලෙක්ට්රොනික වින්යාසයන් ලියා ඇත. කක්ෂය අනුක්රමිකව ලියා ඇති අතර, එක් එක් කාක්ෂිකයේ ඇති පරමාණු ගණන කක්ෂයේ නමට දකුණු පසින් උඩුකුරු ලෙස ලියා ඇත. සම්පුර්ණ කරන ලද ඉලෙක්ට්රොනික වින්යාසයට උප මට්ටමේ තනතුරු සහ උපසිරසි අනුපිළිවෙලක ස්වරූපය ඇත.
- මෙන්න, උදාහරණයක් ලෙස, සරලම ඉලෙක්ට්රොනික වින්යාසය: 1s 2 2s 2 2p 6 .මෙම වින්යාසය පෙන්නුම් කරන්නේ 1s උප මට්ටමේ ඉලෙක්ට්රෝන දෙකක්, 2s උප මට්ටමේ ඉලෙක්ට්රෝන දෙකක් සහ 2p උප මට්ටමේ ඉලෙක්ට්රෝන හයක් ඇති බවයි. 2 + 2 + 6 = මුළු ඉලෙක්ට්රෝන 10 කි. උදාසීන නියොන් පරමාණුවේ ඉලෙක්ට්රොනික වින්යාසය මෙයයි (නියොන් පරමාණුක ක්රමාංකය 10).
-
කක්ෂවල අනුපිළිවෙල මතක තබා ගන්න.ඉලෙක්ට්රෝන කක්ෂය ඉලෙක්ට්රෝන කවචයේ ආරෝහණ අනුපිළිවෙලින් අංකනය කර ඇති නමුත් ආරෝහණ ශක්ති අනුපිළිවෙලට සකස් කර ඇති බව මතක තබා ගන්න. උදාහරණයක් ලෙස, පුරවන ලද 4s 2 කක්ෂයක අර්ධ වශයෙන් පුරවන ලද හෝ පුරවන ලද 3d 10 ට වඩා අඩු ශක්තියක් (හෝ අඩු සංචලනය) ඇත, එබැවින් 4s කාක්ෂිකය පළමුව ලියා ඇත. ඔබ කක්ෂවල අනුපිළිවෙල දැනගත් පසු, ඔබට පරමාණුවේ ඇති ඉලෙක්ට්රෝන ගණන අනුව ඒවා පහසුවෙන් පිරවිය හැකිය. කක්ෂය පුරවා ඇති අනුපිළිවෙල පහත පරිදි වේ: 1s, 2s, 2p, 3s, 3p, 4s, 3d, 4p, 5s, 4d, 5p, 6s, 4f, 5d, 6p, 7s, 5f, 6d, 7p.
- සියලුම කාක්ෂික පුරවා ඇති පරමාණුවක ඉලෙක්ට්රොනික වින්යාසය පහත පෝරමය ඇත: 10 7p 6
- ඉහත අංකනය, සියලු කක්ෂ පුරවා ඇති විට, ආවර්තිතා වගුවේ ඉහළම අංක සහිත පරමාණුව වන Uuo (ununoctium) 118 මූලද්රව්යයේ ඉලෙක්ට්රොනික වින්යාසය බව සලකන්න. එබැවින්, මෙම ඉලෙක්ට්රොනික වින්යාසය මධ්යස්ථව ආරෝපිත පරමාණුවක දැනට දන්නා සියලුම ඉලෙක්ට්රොනික උප මට්ටම් අඩංගු වේ.
-
ඔබේ පරමාණුවේ ඇති ඉලෙක්ට්රෝන ගණන අනුව කාක්ෂික පුරවන්න.උදාහරණයක් ලෙස, අපට උදාසීන කැල්සියම් පරමාණුවක ඉලෙක්ට්රොනික වින්යාසය ලිවීමට අවශ්ය නම්, අපි ආවර්තිතා වගුවේ එහි පරමාණුක ක්රමාංකය බැලීමෙන් ආරම්භ කළ යුතුය. එහි පරමාණුක ක්රමාංකය 20 වන බැවින් ඉහත අනුපිළිවෙලට අනුව ඉලෙක්ට්රෝන 20ක් සහිත පරමාණුවක වින්යාසය ලියන්නෙමු.
- ඔබ විසිවන ඉලෙක්ට්රෝනයට ළඟා වන තෙක් ඉහත අනුපිළිවෙලෙහි කාක්ෂික පුරවන්න. පළමු 1s කක්ෂයට ඉලෙක්ට්රෝන දෙකක් ද, 2s කක්ෂයට ද දෙකක් ද, 2p කක්ෂයට 6ක් ද, 3s කක්ෂයට දෙකක් ද, 3p කක්ෂයට 6ක් ද, 4s කක්ෂයට 6ක් ද, 4s කක්ෂයට 2ක් ද ඇත (2 + 2 + 6 +2 +6 + 2 = 20 .) වෙනත් වචන වලින් කිවහොත්, කැල්සියම් ඉලෙක්ට්රොනික වින්යාසය ආකෘතිය ඇත: 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 .
- කාක්ෂික ශක්තියේ ආරෝහණ අනුපිළිවෙලෙහි පවතින බව සලකන්න. උදාහරණයක් ලෙස, ඔබ 4 වන ශක්ති මට්ටමට යාමට සූදානම් වන විට, පළමුව 4s කක්ෂය ලියන්න, සහ එවිට 3d. සිව්වන ශක්ති මට්ටමෙන් පසු, ඔබ පස්වන ස්ථානයට ගමන් කරයි, එහිදී එකම අනුපිළිවෙල නැවත නැවතත් සිදු වේ. මෙය සිදු වන්නේ තුන්වන ශක්ති මට්ටමෙන් පසුව පමණි.
-
දෘශ්ය ඉඟියක් ලෙස ආවර්තිතා වගුව භාවිතා කරන්න.ආවර්තිතා වගුවේ හැඩය ඉලෙක්ට්රොනික වින්යාසයන්හි ඉලෙක්ට්රොනික උප මට්ටම් අනුපිළිවෙලට අනුරූප වන බව ඔබ දැනටමත් දැක ඇති. උදාහරණයක් ලෙස, වමේ සිට දෙවන තීරුවේ ඇති පරමාණු සෑම විටම "s 2" වලින් අවසන් වන අතර තුනී මැද කොටසේ දකුණු කෙළවරේ ඇති පරමාණු සෑම විටම "d 10" වලින් අවසන් වේ. වින්යාස ලිවීම සඳහා දෘශ්ය මාර්ගෝපදේශයක් ලෙස ආවර්තිතා වගුව භාවිතා කරන්න - ඔබ කක්ෂයට එකතු කරන අනුපිළිවෙල වගුවේ ඔබගේ ස්ථානයට අනුරූප වේ. පහත බලන්න:
- විශේෂයෙන්, වම් කෙළවරේ තීරු දෙකෙහි ඉලෙක්ට්රොනික වින්යාසයන් s කාක්ෂික වලින් අවසන් වන පරමාණු අඩංගු වේ, මේසයේ දකුණු කොටසෙහි වින්යාසය p කාක්ෂික වලින් අවසන් වන පරමාණු සහ පරමාණුවල පතුලේ f කාක්ෂික වලින් අවසන් වේ.
- උදාහරණයක් ලෙස, ඔබ ක්ලෝරීන් ඉලෙක්ට්රොනික වින්යාසය ලියා තබන විට, මෙසේ සිතන්න: "මෙම පරමාණුව ආවර්තිතා වගුවේ තුන්වන පේළියේ (හෝ "කාලසීමාව") පිහිටා ඇත. එය කාක්ෂික බ්ලොක් p හි පස්වන කාණ්ඩයේ ද පිහිටා ඇත. ආවර්තිතා වගුවේ එම නිසා, එහි ඉලෙක්ට්රොනික වින්යාසය අවසන් වන්නේ ..3p 5
- වගුවේ d සහ f කාක්ෂික කලාපවල ඇති මූලද්රව්ය ඒවා පිහිටා ඇති කාල සීමාවට අනුරූප නොවන ශක්ති මට්ටම් ඇති බව සලකන්න. නිදසුනක් ලෙස, d-කාක්ෂික සහිත මූලද්රව්ය සමූහයක පළමු පේළිය 3d කාක්ෂික වලට අනුරූප වේ, එය 4 වන කාල පරිච්ෙඡ්දය තුළ පිහිටා ඇතත්, f-කාක්ෂික සහිත මූලද්රව්යවල පළමු පේළිය 4f කාක්ෂිකයට අනුරූප වේ, එය එසේ වුවද. 6 වන කාල පරිච්ඡේදයේ පිහිටා ඇත.
-
දිගු ඉලෙක්ට්රොනික වින්යාස ලිවීම සඳහා කෙටි යෙදුම් ඉගෙන ගන්න.ආවර්තිතා වගුවේ දකුණු පස ඇති පරමාණු ලෙස හැඳින්වේ උච්ච වායු.මෙම මූලද්රව්ය රසායනිකව ඉතා ස්ථායී වේ. දිගු ඉලෙක්ට්රෝන වින්යාසයන් ලිවීමේ ක්රියාවලිය කෙටි කිරීම සඳහා, ඔබේ පරමාණුවට වඩා අඩු ඉලෙක්ට්රෝන සහිත ආසන්නතම උච්ච වායුව සඳහා රසායනික සංකේතය හතරැස් වරහන් තුළ ලියන්න, ඉන්පසු පසුකාලීන කාක්ෂික මට්ටම්වල ඉලෙක්ට්රොනික වින්යාසය දිගටම ලියන්න. පහත බලන්න:
- මෙම සංකල්පය අවබෝධ කර ගැනීම සඳහා, උදාහරණ වින්යාසයක් ලිවීම ප්රයෝජනවත් වනු ඇත. උච්ච වායු කෙටි යෙදුම භාවිතයෙන් සින්ක් (පරමාණුක ක්රමාංකය 30) වින්යාසය ලියන්නෙමු. සම්පූර්ණ සින්ක් වින්යාසය මෙලෙස දිස්වේ: 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 . කෙසේ වෙතත්, 1s 2 2s 2 2p 6 3s 2 3p 6 යනු උච්ච වායුවක් වන ආගන් හි ඉලෙක්ට්රොනික වින්යාසය බව අපට පෙනේ. සින්ක් වල ඉලෙක්ට්රොනික වින්යාස කොටස ආගන් සඳහා රසායනික සංකේතය සමඟ වර්ග වරහන් (.) ආදේශ කරන්න.
- එබැවින්, සින්ක් වල ඉලෙක්ට්රොනික වින්යාසය, කෙටි ආකාරයෙන් ලියා ඇත: 4s 2 3d 10 .
- ඔබ උච්ච වායුවක ඉලෙක්ට්රොනික වින්යාසය ලියන්නේ නම්, ආගන් කියන්න, ඔබට ලිවිය නොහැකි බව සලකන්න! මෙම මූලද්රව්යය ඉදිරිපිට උච්ච වායුවේ කෙටි යෙදුම භාවිතා කළ යුතුය; ආගන් සඳහා එය නියොන් () වනු ඇත.
ADOMAH ආවර්තිතා වගුව භාවිතා කිරීම
-
ADOMAH ආවර්තිතා වගුව ප්රගුණ කරන්න.ඉලෙක්ට්රොනික වින්යාසය පටිගත කිරීමේ මෙම ක්රමයට කටපාඩම් කිරීම අවශ්ය නොවේ, කෙසේ වෙතත්, එයට නවීකරණය කරන ලද ආවර්තිතා වගුවක් අවශ්ය වේ, මන්ද සම්ප්රදායික ආවර්තිතා වගුවේ, සිව්වන කාල පරිච්ඡේදයේ සිට ආරම්භ වන කාල අංකය ඉලෙක්ට්රෝන කවචයට අනුරූප නොවේ. විද්යාඥ වැලරි සිමර්මන් විසින් නිර්මාණය කරන ලද විශේෂ ආවර්තිතා වගුවක් වන ADOMAH ආවර්තිතා වගුව සොයා ගන්න. කෙටි අන්තර්ජාල සෙවුමකින් එය සොයා ගැනීම පහසුය.
- ADOMAH ආවර්තිතා වගුවේ, තිරස් පේළි මගින් හැලජන්, උච්ච වායු, ක්ෂාර ලෝහ, ක්ෂාරීය පෘථිවි ලෝහ වැනි මූලද්රව්ය කාණ්ඩ නියෝජනය කරයි. සිරස් තීරු ඉලෙක්ට්රොනික මට්ටම් වලට අනුරූප වන අතර ඊනියා "කැස්කැඩ්" (බ්ලොක් s, p, d සහ f සම්බන්ධ කරන විකර්ණ රේඛා) කාල පරිච්ඡේද වලට අනුරූප වේ.
- මෙම මූලද්රව්ය දෙකම 1s කක්ෂයකින් සංලක්ෂිත වන බැවින් හීලියම් හයිඩ්රජන් වෙත ගෙන යයි. කාල සීමාවන් (s,p,d සහ f) දකුණු පසින් පෙන්වා ඇති අතර මට්ටම් අංක පහළින් දක්වා ඇත. මූලද්රව්ය 1 සිට 120 දක්වා අංක සහිත කොටු තුළ නිරූපණය කෙරේ. මෙම සංඛ්යා සාමාන්ය පරමාණුක ක්රමාංක වන අතර එය උදාසීන පරමාණුවක ඇති මුළු ඉලෙක්ට්රෝන සංඛ්යාව නියෝජනය කරයි.
-
ADOMAH වගුවේ ඔබේ පරමාණුව සොයන්න.මූලද්රව්යයක ඉලෙක්ට්රොනික වින්යාසය ලිවීමට, ADOMAH ආවර්තිතා වගුවේ එහි සංකේතය සොයාගෙන ඉහළ පරමාණුක ක්රමාංකයක් සහිත සියලුම මූලද්රව්ය හරස් කරන්න. උදාහරණයක් ලෙස, ඔබට erbium (68) හි ඉලෙක්ට්රොනික වින්යාසය ලිවීමට අවශ්ය නම්, 69 සිට 120 දක්වා සියලුම මූලද්රව්ය හරස් කරන්න.
- මේසයේ පාදයේ 1 සිට 8 දක්වා සංඛ්යා වෙත අවධානය යොමු කරන්න. මේවා ඉලෙක්ට්රොනික මට්ටමේ අංක හෝ තීරු අංක වේ. හරස් වූ අයිතම පමණක් අඩංගු තීරු නොසලකා හරින්න. erbium සඳහා, අංක 1,2,3,4,5 සහ 6 සහිත තීරු ඉතිරි වේ.
-
ඔබේ මූලද්රව්යය දක්වා කක්ෂීය උප මට්ටම් ගණන් කරන්න.වගුවේ දකුණු පසින් පෙන්වා ඇති බ්ලොක් සංකේත (s, p, d, සහ f) සහ පහළින් පෙන්වා ඇති තීරු අංක දෙස බලමින්, කුට්ටි අතර විකර්ණ රේඛා නොසලකා හැර තීරු තීරු-තීරු වලට කඩා ඒවා ලැයිස්තුගත කරන්න. පහළ සිට ඉහළට ඇණවුම් කරන්න. නැවතත්, සියලුම මූලද්රව්ය හරස් කර ඇති කුට්ටි නොසලකා හරින්න. තීරු අංකයෙන් ආරම්භ වන තීරු කුට්ටි ලියන්න, බ්ලොක් සංකේතය, මේ අනුව: 1s 2s 2p 3s 3p 3d 4s 4p 4d 4f 5s 5p 6s (erbium සඳහා).
- කරුණාකර සටහන් කරන්න: ඉහත ඉලෙක්ට්රොනික වින්යාසය Er ලියා ඇත්තේ ඉලෙක්ට්රොනික උප මට්ටමේ අංකයේ ආරෝහණ අනුපිළිවෙලට ය. එය කාක්ෂික පුරවා ඇති අනුපිළිවෙලින් ද ලිවිය හැකිය. මෙය සිදු කිරීම සඳහා, ඔබ තීරු කුට්ටි ලියන විට තීරු නොව පහළ සිට ඉහළට කැස්කැඩ් අනුගමනය කරන්න: 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 12 .
-
එක් එක් ඉලෙක්ට්රොනික උප මට්ටම සඳහා ඉලෙක්ට්රෝන ගණන් කරන්න.සෑම මූලද්රව්යයකින්ම එක් ඉලෙක්ට්රෝනයක් ඇමිණීමෙන් හරස් නොකළ එක් එක් තීරු කොටසෙහි ඇති මූලද්රව්ය ගණන් කරන්න, සහ එක් එක් තීරු බ්ලොක් එක සඳහා බ්ලොක් සංකේතය අසල ඒවායේ අංකය පහත පරිදි ලියන්න: 1s 2 2s 2 2p 6 3s 2 3p 6 3d 10 4s 2 4p 6 4d 10 4f 12 5s 2 5p 6 6s 2 . අපගේ උදාහරණයේ දී, මෙය erbium හි ඉලෙක්ට්රොනික වින්යාසයයි.
-
වැරදි ඉලෙක්ට්රොනික සැකසුම් ගැන දැනුවත් වන්න.අඩුම ශක්ති තත්වයේ පරමාණු වල ඉලෙක්ට්රොනික වින්යාසයන් හා සම්බන්ධ සාමාන්ය ව්යතිරේක දහඅටක් ඇත, එය භූ ශක්ති තත්වය ලෙසද හැඳින්වේ. ඔවුන් සාමාන්ය රීතියට අවනත නොවන්නේ ඉලෙක්ට්රෝන විසින් අල්ලාගෙන සිටින අවසාන ස්ථාන දෙක තුනේදී පමණි. මෙම අවස්ථාවෙහිදී, සැබෑ ඉලෙක්ට්රොනික වින්යාසය පරමාණුවේ සම්මත වින්යාසයට සාපේක්ෂව ඉලෙක්ට්රෝන අඩු ශක්ති තත්වයක පවතින බව උපකල්පනය කරයි. ව්යතිරේක පරමාණු ඇතුළත් වේ:
- ක්රි(..., 3d5, 4s1); කියු(..., 3d10, 4s1); සැ.යු(..., 4d4, 5s1); මෝ(..., 4d5, 5s1); රු(..., 4d7, 5s1); Rh(..., 4d8, 5s1); Pd(..., 4d10, 5s0); අග්(..., 4d10, 5s1); ලා(..., 5d1, 6s2); සී(..., 4f1, 5d1, 6s2); Gd(..., 4f7, 5d1, 6s2); Au(..., 5d10, 6s1); AC(..., 6d1, 7s2); ත(..., 6d2, 7s2); පා(..., 5f2, 6d1, 7s2); යූ(..., 5f3, 6d1, 7s2); එන්පී(..., 5f4, 6d1, 7s2) සහ සෙමී(..., 5f7, 6d1, 7s2).
- පරමාණුවක පරමාණුක ක්රමාංකය ඉලෙක්ට්රොනික ආකාරයෙන් ලියා ඇති විට එය සොයා ගැනීමට, අකුරු (s, p, d, සහ f) අනුගමනය කරන සියලුම සංඛ්යා එකතු කරන්න. මෙය ක්රියාත්මක වන්නේ උදාසීන පරමාණු සඳහා පමණි, ඔබ අයනයක් සමඟ කටයුතු කරන්නේ නම්, කිසිවක් ක්රියා නොකරනු ඇත - ඔබට අමතර හෝ නැතිවූ ඉලෙක්ට්රෝන ගණන එකතු කිරීමට හෝ අඩු කිරීමට සිදුවේ.
- ලිපියට පසුව ඇති අංකය උපරි පිටපතකි, පාලනයේ වැරැද්දක් නොකරන්න.
- "අඩක් පිරවූ" උප මට්ටමේ ස්ථාවරත්වය නොපවතී. මෙය සරල කිරීමකි. "අර්ධ-සම්පූර්ණ" උප මට්ටම් වලට අදාළ ඕනෑම ස්ථායීතාවයක් ඇති වන්නේ සෑම කක්ෂයක්ම එක් ඉලෙක්ට්රෝනයක් විසින් අල්ලාගෙන සිටීම නිසා ඉලෙක්ට්රෝන අතර විකර්ෂණය අවම වේ.
- සෑම පරමාණුවක්ම ස්ථායී තත්ත්වයකට නැඹුරු වන අතර, වඩාත්ම ස්ථායී වින්යාසය s සහ p (s2 සහ p6) උප මට්ටම් පුරවා ඇත. උච්ච වායුවලට මෙම වින්යාසය ඇත, එබැවින් ඒවා කලාතුරකින් ප්රතික්රියා කරන අතර ආවර්තිතා වගුවේ දකුණු පසින් පිහිටා ඇත. එබැවින්, වින්යාසයක් 3p 4 කින් අවසන් වන්නේ නම්, ස්ථායී තත්ත්වයකට පැමිණීමට ඉලෙක්ට්රෝන දෙකක් අවශ්ය වේ (s-ලෙවල් ඉලෙක්ට්රෝන ද ඇතුළුව හයක් අහිමි වීමට වැඩි ශක්තියක් අවශ්ය වේ, එබැවින් හතරක් නැතිවීම පහසුය). තවද වින්යාසය 4d 3 න් අවසන් වන්නේ නම්, ස්ථායී තත්ත්වයකට පැමිණීමට ඉලෙක්ට්රෝන තුනක් අහිමි විය යුතුය. මීට අමතරව, අඩක් පිරවූ උප මට්ටම් (s1, p3, d5..) උදාහරණයක් ලෙස, p4 හෝ p2 ට වඩා ස්ථායී වේ; කෙසේ වෙතත්, s2 සහ p6 වඩාත් ස්ථායී වනු ඇත.
- ඔබ අයනයක් සමඟ කටයුතු කරන විට, එයින් අදහස් වන්නේ ප්රෝටෝන ගණන ඉලෙක්ට්රෝන ගණනට සමාන නොවන බවයි. මෙම නඩුවේ පරමාණුවේ ආරෝපණය රසායනික සංකේතයේ ඉහළ දකුණේ (සාමාන්යයෙන්) පෙන්වනු ඇත. එබැවින්, +2 ආරෝපණයක් සහිත ඇන්ටිමනි පරමාණුවක ඉලෙක්ට්රොනික වින්යාසය 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 1 ඇත. 5p 3 5p 1 ලෙස වෙනස් වී ඇති බව සලකන්න. උදාසීන පරමාණුවක වින්යාසය s සහ p හැර වෙනත් උප මට්ටම් වලින් අවසන් වන විට ප්රවේශම් වන්න.ඔබ ඉලෙක්ට්රෝන ගන්නා විට, ඔබට ඒවා ගත හැක්කේ සංයුජතා කාක්ෂික (s සහ p orbitals) වලින් පමණි. එබැවින්, වින්යාසය 4s 2 3d 7 න් අවසන් වී පරමාණුවට +2 ආරෝපණයක් ලැබෙන්නේ නම්, එවිට වින්යාසය 4s 0 3d 7 න් අවසන් වේ. 3d 7 බව කරුණාවෙන් සලකන්න නැහැවෙනස්කම්, ඒ වෙනුවට s-කාක්ෂිකයේ ඉලෙක්ට්රෝන නැති වී යයි.
- ඉලෙක්ට්රෝනයක් "ඉහළ ශක්ති මට්ටමකට ගමන් කිරීමට" බල කරන විට කොන්දේසි තිබේ. උපමට්ටමක අර්ධ හෝ සම්පූර්ණ වීමට එක් ඉලෙක්ට්රෝනයක් නොමැති විට, ළඟම ඇති s හෝ p උප මට්ටමේ සිට එක් ඉලෙක්ට්රෝනයක් ගෙන එය ඉලෙක්ට්රෝනයක් අවශ්ය උප මට්ටමට ගෙන යන්න.
- ඉලෙක්ට්රොනික වින්යාසයක් ලිවීම සඳහා විකල්ප දෙකක් තිබේ. ඒවා එර්බියම් සඳහා ඉහත පෙන්වා ඇති පරිදි ශක්ති මට්ටම් සංඛ්යාවල ආරෝහණ අනුපිළිවෙලට හෝ ඉලෙක්ට්රෝන කක්ෂ පුරවා ඇති අනුපිළිවෙලට ලිවිය හැකිය.
- අවසාන s සහ p උප මට්ටම වන සංයුජතා වින්යාසය පමණක් ලිවීමෙන් ඔබට මූලද්රව්යයක ඉලෙක්ට්රොනික වින්යාසය ලිවිය හැකිය. මේ අනුව, ඇන්ටිමනි වල සංයුජතා වින්යාසය 5s 2 5p 3 වනු ඇත.
- අයන සමාන නොවේ. ඔවුන් සමඟ එය වඩා දුෂ්කර ය. මට්ටම් දෙකක් මඟ හැර ඔබ ආරම්භ කළ ස්ථානය සහ ඉලෙක්ට්රෝන සංඛ්යාව කෙතරම් ඉහළද යන්න මත එකම රටාව අනුගමනය කරන්න.
ඔබේ පරමාණුවේ පරමාණුක ක්රමාංකය සොයන්න.සෑම පරමාණුවකටම ඒ හා සම්බන්ධ නිශ්චිත ඉලෙක්ට්රෝන සංඛ්යාවක් ඇත. ආවර්තිතා වගුවේ ඔබේ පරමාණුව සඳහා සංකේතය සොයන්න. පරමාණුක ක්රමාංකය යනු 1 (හයිඩ්රජන් සඳහා) සිට ආරම්භ වන ධන නිඛිලයක් වන අතර පසුව එන සෑම පරමාණුවකටම එකකින් වැඩි වේ. පරමාණුක ක්රමාංකය යනු පරමාණුවක ඇති ප්රෝටෝන සංඛ්යාව වන අතර එම නිසා එය ශුන්ය ආරෝපණයක් සහිත පරමාණුවක ඇති ඉලෙක්ට්රෝන සංඛ්යාව ද වේ.
පරමාණුවක ආරෝපණය තීරණය කරන්න.උදාසීන පරමාණුවල ආවර්තිතා වගුවේ පෙන්වා ඇති ඉලෙක්ට්රෝන සංඛ්යාව සමාන වේ. කෙසේ වෙතත්, ආරෝපිත පරමාණු ඒවායේ ආරෝපණයේ විශාලත්වය අනුව ඉලෙක්ට්රෝන වැඩි හෝ අඩු වනු ඇත. ඔබ ආරෝපිත පරමාණුවක් සමඟ වැඩ කරන්නේ නම්, පහත පරිදි ඉලෙක්ට්රෝන එකතු කරන්න හෝ අඩු කරන්න: සෑම සෘණ ආරෝපණයකටම එක් ඉලෙක්ට්රෝනයක් එකතු කරන්න සහ සෑම ධන ආරෝපණයක් සඳහා එකක් අඩු කරන්න.
2. පරමාණුවල න්යෂ්ටි සහ ඉලෙක්ට්රෝන කවචවල ව්යුහය
2.6 ශක්ති මට්ටම් සහ උප මට්ටම්
පරමාණුවක ඉලෙක්ට්රෝනයක තත්වයේ වැදගත්ම ලක්ෂණය වන්නේ ඉලෙක්ට්රෝනයේ ශක්තියයි, එය ක්වොන්ටම් යාන්ත්ර විද්යාවේ නියමයන්ට අනුව අඛණ්ඩව වෙනස් නොවන නමුත් හදිසියේ, i.e. හොඳින් අර්ථ දක්වා ඇති අගයන් පමණක් ගත හැක. මේ අනුව, පරමාණුවේ ශක්ති මට්ටම් කට්ටලයක් තිබීම ගැන අපට කතා කළ හැකිය.
බලශක්ති මට්ටම- සමීප ශක්ති අගයන් සහිත AO කට්ටලයක්.
ශක්ති මට්ටම් අංකනය කර ඇත ප්රධාන ක්වොන්ටම් අංකය n, ධන නිඛිල අගයන් පමණක් ගත හැක (n = 1, 2, 3, ...). n හි අගය විශාල වන තරමට ඉලෙක්ට්රෝනයේ ශක්තිය සහ ලබා දී ඇති ශක්ති මට්ටම ඉහළ යයි. සෑම පරමාණුවකම ශක්ති මට්ටම් අනන්ත සංඛ්යාවක් අඩංගු වන අතර, ඒවායින් සමහරක් පරමාණුවේ භූගත තත්වයේ ඉලෙක්ට්රෝන මගින් ජනාකීර්ණ වන අතර සමහර ඒවා එසේ නොවේ (මෙම ශක්ති මට්ටම් පරමාණුවේ උද්යෝගිමත් තත්වයේ ජනාකීර්ණ වේ).
ඉලෙක්ට්රොනික ස්ථරය- දී ඇති ශක්ති මට්ටමක පවතින ඉලෙක්ට්රෝන කට්ටලයක්.
වෙනත් වචන වලින් කිවහොත්, ඉලෙක්ට්රෝන ස්ථරයක් යනු ඉලෙක්ට්රෝන අඩංගු ශක්ති මට්ටමකි.
ඉලෙක්ට්රෝන ස්ථර සමූහය පරමාණුවක ඉලෙක්ට්රෝන කවචය සාදයි.
එකම ඉලෙක්ට්රෝන ස්තරය තුළ ඉලෙක්ට්රෝන ශක්තියෙන් තරමක් වෙනස් විය හැකි අතර ඒ නිසා ඔවුන් එසේ කියයි ශක්ති මට්ටම් ශක්ති උප මට්ටම් වලට බෙදී ඇත(උපස්ථයන්). දී ඇති ශක්ති මට්ටමක් බෙදී ඇති උප මට්ටම් ගණන ශක්ති මට්ටමේ ප්රධාන ක්වොන්ටම් අංකයේ සංඛ්යාවට සමාන වේ:
N (උප) \u003d n (මට්ටම) . (2.4)
උප මට්ටම් අංක සහ අකුරු භාවිතයෙන් නිරූපණය කෙරේ: අංකය ශක්ති මට්ටමේ (ඉලෙක්ට්රොනික ස්ථරය) අංකයට අනුරූප වේ, ලිපිය උප මට්ටම් සාදන AO හි ස්වභාවයට අනුරූප වේ (s -, p -, d -, f -), උදාහරණයක් ලෙස: 2p - sublevel (2p - AO, 2p -electron).
මේ අනුව, පළමු ශක්ති මට්ටම (රූපය 2.5) සමන්විත වන්නේ එක් උප මට්ටමකින් (1s), දෙවන - දෙකෙන් (2s සහ 2p), තෙවන - තුනෙන් (3s, 3p සහ 3d), හතරෙන් හතරෙන් (4s, 4p, 4d සහ 4f) ආදිය. එක් එක් උප මට්ටමේ AO නිශ්චිත සංඛ්යාවක් අඩංගු වේ:
N (AO) = n 2 . (2.5)
සහල්. 2.5 පළමු ඉලෙක්ට්රෝන ස්ථර තුන සඳහා ශක්ති මට්ටම් සහ උප මට්ටම් යෝජනා ක්රමය
1. s-වර්ගය AOs සියලු ශක්ති මට්ටම් වල පවතී, p-වර්ගය දෙවන ශක්ති මට්ටමෙන් ආරම්භ වේ, d-වර්ගය - තෙවන සිට, f-වර්ගය - හතරවන සිට, ආදිය.
2. දී ඇති ශක්ති මට්ටමකදී, s -, තුනක් p -, පහ d -, හත f -කාක්ෂික තිබිය හැක.
3. ප්රධාන ක්වොන්ටම් අංකය විශාල වන තරමට AO හි ප්රමාණය විශාල වේ.
එක් AO එකක ඉලෙක්ට්රෝන දෙකකට වඩා තිබිය නොහැකි බැවින්, දී ඇති ශක්ති මට්ටමේ මුළු (උපරිම) ඉලෙක්ට්රෝන සංඛ්යාව AO සංඛ්යාවට වඩා 2 ගුණයකින් වැඩි වන අතර එය සමාන වේ:
N (e) = 2n 2 . (2.6)
මේ අනුව, දී ඇති ශක්ති මට්ටමකදී, උපරිම වශයෙන් s-වර්ගයේ ඉලෙක්ට්රෝන 2ක්, p-වර්ගයේ ඉලෙක්ට්රෝන 6ක් සහ d-වර්ගයේ ඉලෙක්ට්රෝන 10ක් තිබිය හැක. සමස්තයක් වශයෙන්, පළමු ශක්ති මට්ටමේදී, උපරිම ඉලෙක්ට්රෝන ගණන 2, දෙවන - 8 (2 s-වර්ගය සහ 6 p-වර්ගය), තෙවන - 18 (2 s-type, 6 p-type සහ 10 d-වර්ගය). මෙම සොයාගැනීම් පහසුවෙන් 1 වගුවේ සාරාංශ කර ඇත. 2.2
වගුව 2.2
ප්රධාන ක්වොන්ටම් අංකය අතර සම්බන්ධය, අංකය e
පරමාණුවක ඉලෙක්ට්රෝනයක තත්ත්වය විස්තර කිරීමට, ක්වොන්ටම් සංඛ්යා වලට අමතරව, ඔවුන් භාවිතා කරන්නේ:
- පරමාණුක ශක්ති මට්ටමේ රූප සටහන්;
- ඉලෙක්ට්රොනික සූත්ර හෝ වින්යාස.
බලශක්ති මට්ටමේ සටහන
සහල්. පරමාණුවේ ශක්ති මට්ටම් සහ උප මට්ටම්.
ඕනෑම පරමාණුවක ඉලෙක්ට්රෝන විස්තර කිරීමට භාවිතා කළ හැකි පරමාණුවක මට්ටමේ රූප සටහන රූපයේ දැක්වේ.
බලශක්ති මට්ටම්පරමාණු (ඉලෙක්ට්රෝන පරමාණුක ස්තර සාදන ඉලෙක්ට්රෝන වලාකුළු) සංඛ්යා මගින් දැක්වේ 1, 2, 3, 4 ...
බලශක්ති උප මට්ටම්පරමාණු (පරමාණුක න්යෂ්ටියක් සහිත ඉලෙක්ට්රෝනයක බන්ධන ශක්තිය සංලක්ෂිත ශක්ති මට්ටම්) අක්ෂර වලින් දැක්වේ s, p, d, f.
ශක්ති උප මට්ටම් ක්වොන්ටම් සෛල ලෙස පෙන්විය හැක (දකුණු පස ඇති රූපය): නිදහස් (හිස් සෛල); අර්ධ වශයෙන් පුරවා ඇත (එක් සිරස් ඊතලයක් ඉහළට හෝ පහළට යොමු කිරීම, යුගල නොකළ ඉලෙක්ට්රෝනයක් පෙන්නුම් කරයි); සම්පුර්ණයෙන්ම පුරවා ඇත (යුගලිත ඉලෙක්ට්රෝන දැක්වෙන සිරස් වෙනස් ලෙස යොමු කරන ලද ඊතල දෙකක්).
පරමාණුවේ ඉලෙක්ට්රොනික සූත්රය
ශක්ති මට්ටමේ රූප සටහන් වල ඇති සෑම දෙයක්ම තරමක් පැහැදිලි සහ දෘශ්යමාන, නමුත් අපහසුයි. ඉලෙක්ට්රොනික වින්යාසය භාවිතා කරමින්, රූප සටහන එක් කෙටි රේඛාවකින් ප්රකාශ කළ හැක.
ඉලෙක්ට්රෝන 6ක් පමණක් ඇති (ඇතුළත 2 සහ පිටත 4) ශක්ති මට්ටම් දෙකක් ඇති කාබන් පරමාණුවක් සලකා බලන්න:

කාබන් සහ සෝඩියම් පරමාණුවල ඉලෙක්ට්රොනික සූත්ර (ඉලෙක්ට්රෝන කවචයේ ආකෘතිය) සහ ඒවායේ ග්රැෆික් නිරූපණය පිළිබඳ උදාහරණ පහත රූපවල දැක්වේ.

සහල්. කාබන් ඉලෙක්ට්රොනික සූත්රය.

සහල්. සෝඩියම් ඉලෙක්ට්රොනික සූත්රය.
ඉලෙක්ට්රෝන වින්යාසයේදී, ශක්ති මට්ටමේ කක්ෂයේ නම මෙම කක්ෂයේ පිහිටා ඇති ඉලෙක්ට්රෝන සංඛ්යාව වන උපරි පිටපතෙහි දක්වා ඇත.
පරමාණුවක ඉලෙක්ට්රෝන කවචය සෑදී ඇත්තේ පහත සඳහන් මූලධර්ම අනුව ය.
- අවම බලශක්ති මූලධර්මය- අඩුම ශක්තිය (පරමාණුක න්යෂ්ටියට ආසන්න) සහිත කක්ෂ පළමුව පුරවනු ලැබේ:
1s; තත්පර 2; 2p; 3s; 3p; 4s (3d); 4p; 5s (4d); 5p; 6s(4f)(5d); 6p; 7s; - පෝලි මූලධර්මය- එක් පරමාණුක කාක්ෂිකයක ප්රතිවිරුද්ධ භ්රමණයන් සහිත ඉලෙක්ට්රෝන 2 කට වඩා තිබිය නොහැක (යුගලිත ඉලෙක්ට්රෝන);
- hund රීතිය- පරමාණුක කාක්ෂික පුරවා ඇත්තේ ඒවායේ භ්රමණයන්හි එකතුව උපරිම වන ආකාරයට ය.
උදාහරණයක් ලෙස, ක්ලෝරීන් සඳහා ඉලෙක්ට්රොනික සූත්රය වන්නේ: 1s 2 2s 2 2p 6 3s 2 3p 5 .
වගුවේ ඇති ක්ලෝරීන් අනුක්රමික අංකය 17. මෙයින් අදහස් කරන්නේ ක්ලෝරීන් පරමාණුවේ ප්රෝටෝන 17 ක් සහ ඉලෙක්ට්රෝන 17 ක් අඩංගු වන බවයි. එනම්, අපි රූප සටහන මත ඉලෙක්ට්රෝන 17 ක් තැබිය යුතුය (නීති වලට අනුව).
ඉහත සඳහන් කළ පරිදි, ක්රමානුකූලව, ඉලෙක්ට්රෝනය ඊතලයක් ලෙස පෙන්වයි. කක්ෂයේ ඉලෙක්ට්රෝන දෙකක් තිබේ නම්, ඒවා වෙනස් ලෙස යොමු කරන ලද ඊතල දෙකක් (විවිධ භ්රමණයන් සහිත ඉලෙක්ට්රෝන) ලෙස පෙන්වනු ලැබේ.
- පළමුව, අපි අවම ශක්ති මට්ටම පුරවන්නෙමු: 1s කක්ෂය. එහි ඉලෙක්ට්රෝන 2ක් ඇත.
- ඊළඟ ඉලෙක්ට්රෝන 2 2s කක්ෂය අල්ලා ගනී.
- ඊළඟ ශක්ති මට්ටම: 2p කාක්ෂික - ඉලෙක්ට්රෝන 6ක්.
- ඊළඟ ඉලෙක්ට්රෝන 2 3s කක්ෂයයි.
- ඉතිරි ඉලෙක්ට්රෝන 5 3p කාක්ෂිකයේ පිහිටා ඇති අතර එය භ්රමණය යුගල දෙකක් සාදයි (අවසාන ඉලෙක්ට්රෝනයට යුගලයක් නොමැත).
එබැවින් ක්ලෝරීන් සඳහා ශක්ති මට්ටමේ රූප සටහන මේ ආකාරයෙන් පෙනෙනු ඇත:

අවධානය යොමු කරන පාඨකයා, බොහෝ දුරට, පරමාණුවල ඉලෙක්ට්රොනික ශක්ති උප මට්ටම් පිරවීමේ අනුපිළිවෙල තරමක් බාධා ඇති බව දුටුවේය, උදාහරණයක් ලෙස, 4s උප මට්ටම පළමුව පුරවා ඇති අතර පසුව පමණක් 3d. මෙම උල්ලංඝනය පැහැදිලි කර ඇත ක්ලෙච්කොව්ස්කිගේ පාලනය, ඒ කියන්නේ ඉලෙක්ට්රෝන එකතුවේ (n + l) ආරෝහණ අනුපිළිවෙලින් පරමාණු මට්ටම් (උප මට්ටම්) පුරවයි, ප්රධාන සහ කක්ෂීය ක්වොන්ටම් සංඛ්යාවල එකතුව සමාන නම්, පිරවීම සිදු වන්නේ n වැඩි කිරීමේ අනුපිළිවෙලටය.(පරමාණුවේ ව්යුහයේ ක්වොන්ටම්-යාන්ත්රික ආකෘතිය බලන්න).
- උප මට්ටමේ 4s සඳහා: n+l = 4+0 = 4;
- 3d උප මට්ටම සඳහා; n+l = 3+2 = 5.
උප මට්ටම් 3d, 4p, 5s n+l=5 සමාන එකතුවක් ඇත, එබැවින් පිරවීම ප්රධාන ක්වොන්ටම් අංකයේ ආරෝහණ අනුපිළිවෙලට යයි: 3d→4p→5s.
ක්ලෙච්කොව්ස්කිගේ රීතියට ව්යතිරේක ගණනාවක් ඇත, එකිනෙකට සමීප උප මට්ටම් ශක්තියෙන් තරමක් වෙනස් වන විට, ඉලෙක්ට්රෝනය "අධික" වුවද, "පහළ" මට්ටම පුරවා නොගෙන පවතින අතර, අඩු ශක්තියක් සහිත උප මට්ටමක් අත්පත් කර ගැනීමට නැඹුරු වේ. උදාහරණයක් ලෙස 4f ට පෙර 5d 1 පුරවා ඇත.
- s-මූලද්රව්ය(14): ඉලෙක්ට්රෝන බාහිර මට්ටමේ s-උප මට්ටම පුරවයි - හයිඩ්රජන්, හීලියම් + එක් එක් කාල පරිච්ඡේදයේ පළමු මූලද්රව්ය 2;
- p-මූලද්රව්ය(30): ඉලෙක්ට්රෝන බාහිර මට්ටමේ p-sublevel පුරවයි - එක් එක් කාල පරිච්ඡේදයේ අවසාන මූලද්රව්ය 6;
- d-මූලද්රව්ය(32): ඉලෙක්ට්රෝන පිටත සිට දෙවන මට්ටමේ d-උප මට්ටම පුරවයි - s- සහ p-මූලද්රව්ය අතර ඇති විශාල කාල පරිච්ඡේදවල අන්තර් කාලාන්තර දශකවල මූලද්රව්ය;
- f-මූලද්රව්ය(28): ඉලෙක්ට්රෝන පිටතින් තුන්වන මට්ටමේ f-උප මට්ටම පුරවයි - ලැන්තනයිඩ සහ ඇක්ටිනයිඩ.

සංයුජතා ඉලෙක්ට්රෝන
පරමාණුවක් යනු මධ්යස්ථව ආරෝපිත අංශුවක් බව අප කලින් කීවේ එහි ඇති ඉලෙක්ට්රෝන සහ ප්රෝටෝන සංඛ්යාව සමාන බැවිනි. කෙසේ වෙතත්, පරමාණුවේ න්යෂ්ටියේ ඇති ධනාත්මක ප්රෝටෝන මගින් පිටතම කක්ෂවල ඇති ඉලෙක්ට්රෝන දුර්වල ලෙස ආකර්ෂණය වේ. එම නිසා මූලද්රව්යවල පරමාණුවලට ඉලෙක්ට්රෝන ලබා දීමට සහ සම්බන්ධ කිරීමට හැකි වේ.
දැන ගැනීමට අවශ්යයි!සංයුජතා ඉලෙක්ට්රෝනවලට බාහිර ඉලෙක්ට්රෝන ඇතුළත් වන අතර බාහිර ඒවාට වඩා වැඩි ශක්තියක් ඇති පූර්ව බාහිර ඉලෙක්ට්රෝන ද ඇතුළත් වේ.
එකම අගයක් ඇති පරමාණුවක ඉලෙක්ට්රෝනයක අවස්ථා සමූහය nකියලා ශක්ති මට්ටම. පරමාණුවේ භූගත තත්වයේ ඉලෙක්ට්රෝන පවතින මට්ටම් ගණන මූලද්රව්යය පිහිටා ඇති කාල පරිච්ඡේදයේ සංඛ්යාව සමඟ සමපාත වේ. මෙම මට්ටම්වල අංක අංක වලින් දැක්වේ: 1, 2, 3, ... (අඩු වාර ගණනක් - අකුරු වලින් කේ, එල්, එම්, ...).
බලශක්ති උප මට්ටම- පරමාණුවක ඉලෙක්ට්රෝනයක ශක්ති තත්ත්වයන් සමූහයක්, ක්වොන්ටම් සංඛ්යාවල එකම අගයන් මගින් සංලක්ෂිත වේ nහා එල්. උප මට්ටම් අකුරු වලින් දැක්වේ: s, පි, ඈ, f... පළමු ශක්ති මට්ටමට එක් උප මට්ටමක් ඇත, දෙවන - උප මට්ටම් දෙකක්, තෙවන - උප මට්ටම් තුනක් සහ යනාදිය.
රූප සටහනේ කාක්ෂික සෛල (වර්ග රාමු), ඉලෙක්ට්රෝන ඊතල (හෝ ↓) ලෙස නම් කර ඇත්නම්, ප්රධාන ක්වොන්ටම් අංකය ප්රධාන සහ කක්ෂීය ක්වොන්ටම්වල එකතුව වන ශක්ති මට්ටම (EU) සංලක්ෂිත කරන බව ඔබට දැක ගත හැකිය. සංඛ්යා - ශක්ති උප මට්ටම (EPL), ප්රධාන, කක්ෂීය සහ චුම්බක ක්වොන්ටම් සංඛ්යා සමූහයක් - පරමාණුක කක්ෂය, සහ ක්වොන්ටම් අංක හතරම ඉලෙක්ට්රෝනයකි.
සෑම කක්ෂයක්ම නිශ්චිත ශක්තියකට අනුරූප වේ. කක්ෂයේ නම් කිරීමෙහි ශක්ති මට්ටමේ අංකය සහ ඊට අනුරූප උප මට්ටමට අනුරූප අක්ෂරය ඇතුළත් වේ: 1 s, 3පි, 4ඈආදිය එක් එක් ශක්ති මට්ටම සඳහා, දෙවන සිට ආරම්භ, ශක්තිය සමාන තුනක් පැවැත්ම පිඅන්යෝන්ය වශයෙන් ලම්බක දිශා තුනක පිහිටා ඇති කක්ෂ. එක් එක් ශක්ති මට්ටමේ, තුන්වන සිට ආරම්භ, පහක් ඇත ඈ- වඩාත් සංකීර්ණ පත්ර හතරක හැඩයක් සහිත කක්ෂ. සිව්වන ශක්ති මට්ටමේ සිට ඊටත් වඩා සංකීර්ණ හැඩයන් දිස්වේ. f- කක්ෂ; සෑම මට්ටමකම හතක් ඇත. ඉලෙක්ට්රෝන ආරෝපණයක් සහිත පරමාණුක කක්ෂයක් බොහෝ විට ඉලෙක්ට්රෝන වලාකුළක් ලෙස හැඳින්වේ.
ප්රශ්නය 12.
තිරස් ආවර්තිතා
අයනීකරණ ශක්තිය සහ ඉලෙක්ට්රෝන සම්බන්ධතාවය වැනි භෞතික ගුණාංගවල, තිරස් ආවර්තිතා ද විදහා දක්වයි, අවසාන ශක්ති උප මට්ටම්වල ඉලෙක්ට්රෝන සංඛ්යාවේ ආවර්තිතා වෙනසක් සමඟ සම්බන්ධ වේ:
ප්රශ්නය 13.
ප්රශ්නය 14.
පරමාණුවක චුම්බක ලක්ෂණ
ඉලෙක්ට්රෝනයට තමන්ගේම චුම්භක මොහොතක් ඇත, එය ව්යවහාරික චුම්බක ක්ෂේත්රයට සමාන්තරව හෝ ප්රතිවිරුද්ධ දිශාවට ක්වොන්ටීකරණය වේ. එකම කක්ෂය අල්ලාගෙන සිටින ඉලෙක්ට්රෝන දෙකක් ප්රතිවිරුද්ධ දිශාවට භ්රමණය වී ඇත්නම් (Pauli මූලධර්මය අනුව), එවිට ඒවා එකිනෙක අවලංගු වේ. මෙහිදී ඉලෙක්ට්රෝන යුගලනය වන බව පැවසේ. යුගල කරන ලද ඉලෙක්ට්රෝන පමණක් ඇති පරමාණු චුම්බක ක්ෂේත්රයෙන් පිටතට තල්ලු කරනු ලැබේ. එවැනි පරමාණු diamagnetic ලෙස හැඳින්වේ. යුගල නොකළ ඉලෙක්ට්රෝන එකක් හෝ කිහිපයක් ඇති පරමාණු චුම්භක ක්ෂේත්රයකට ඇද දමනු ලැබේ. ඒවා ඩයමැග්නටික් ලෙස හැඳින්වේ.
චුම්බක ක්ෂේත්රයක් සමඟ පරමාණුවක අන්තර් ක්රියාකාරිත්වයේ තීව්රතාවය සංලක්ෂිත පරමාණුවක චුම්බක මොහොත ප්රායෝගිකව යුගල නොකළ ඉලෙක්ට්රෝන ගණනට සමානුපාතික වේ.
විවිධ මූලද්රව්යවල පරමාණුවල ඉලෙක්ට්රොනික ව්යුහයේ ලක්ෂණ අයනීකරණ ශක්තිය සහ ඉලෙක්ට්රෝන සම්බන්ධතාවය වැනි ශක්ති ලක්ෂණ වලින් පිළිබිඹු වේ.
අයනීකරණ ශක්තිය
පරමාණුවක අයනීකරණයේ ශක්තිය (විභවය). ඊ අයිසමීකරණයට අනුව පරමාණුවක සිට අනන්තය දක්වා ඉලෙක්ට්රෝනයක් ඉවත් කිරීමට අවශ්ය අවම ශක්තිය වේ
X = X + + ඊ- . එහි අගයන් ආවර්තිතා පද්ධතියේ සියලුම මූලද්රව්යවල පරමාණු සඳහා ප්රසිද්ධය. උදාහරණයක් ලෙස, හයිඩ්රජන් පරමාණුවක අයනීකරණ ශක්තිය ඉලෙක්ට්රෝනයක් 1 සිට සංක්රමණය වීමට අනුරූප වේ s- ශුන්ය ශක්තිය සහිත උප මට්ටමට ශක්ති උප මට්ටම (-1312.1 kJ/mol) සහ +1312.1 kJ/mol සමාන වේ.
පරමාණු වල එක් ඉලෙක්ට්රෝනයක් ඉවත් කිරීමට අනුරූප වන පළමු අයනීකරණ විභවයන් වෙනස් කිරීමේදී, ආවර්තිතා පරමාණුවේ සාමාන්ය සංඛ්යාවේ වැඩි වීමක් සමඟ පැහැදිලිව ප්රකාශ වේ:
කාල පරිච්ෙඡ්දය දිගේ වමේ සිට දකුණට ගමන් කරන විට, අයනීකරණ ශක්තිය, සාමාන්යයෙන් කථා කිරීම, ක්රමයෙන් වැඩි වන අතර, කණ්ඩායම තුළ අනුක්රමික අංකය වැඩි කරන අතර, එය අඩු වේ. ක්ෂාර ලෝහවල අවම පළමු අයනීකරණ විභවයන් ඇත, උච්ච වායුවල උපරිම ඒවා ඇත.
එකම පරමාණුව සඳහා, ඉලෙක්ට්රෝනය ධන ආරෝපිත අයනයකින් වෙන් කළ යුතු බැවින්, දෙවන, තුන්වන සහ පසුව අයනීකරණ ශක්තීන් සෑම විටම වැඩි වේ. උදාහරණයක් ලෙස, ලිතියම් පරමාණුවක් සඳහා, පළමු, දෙවන සහ තෙවන අයනීකරණ ශක්තීන් පිළිවෙලින් 520.3, 7298.1 සහ 11814.9 kJ/mol වේ.
ඉලෙක්ට්රෝන වෙන්වීමේ අනුපිළිවෙල සාමාන්යයෙන් අවම ශක්තියේ මූලධර්මයට අනුකූලව ඉලෙක්ට්රෝන මගින් කාක්ෂික ජනගහන අනුපිළිවෙලෙහි ප්රතිලෝම වේ. කෙසේ වෙතත්, ජනාකීර්ණ වන මූලද්රව්ය ඈ- කක්ෂය ව්යතිරේක වේ - පළමුවෙන්ම ඒවා අහිමි නොවේ ඈ-, ඒ s- ඉලෙක්ට්රෝන.
ඉලෙක්ට්රෝන සම්බන්ධතාවය
ඉලෙක්ට්රෝනයක් සඳහා පරමාණුවක ඇති සම්බන්ධය ඒ e - අතිරේක ඉලෙක්ට්රෝනයක් සම්බන්ධ කර සෘණ අයනයක් බවට පත් කිරීමට පරමාණුවලට ඇති හැකියාව. ඉලෙක්ට්රෝන සම්බන්ධතාවයේ මිනුම ක්රියාවලියේදී මුදා හරින හෝ අවශෝෂණය කරන ශක්තියයි. ඉලෙක්ට්රෝන සම්බන්ධතාවය සෘණ අයන X - : X - = X + හි අයනීකරණ ශක්තියට සමාන වේ. ඊ −
හැලජන් පරමාණු වලට ඉහලම ඉලෙක්ට්රෝන සම්බන්ධතාවයක් ඇත. උදාහරණයක් ලෙස, ෆ්ලෝරීන් පරමාණුවක් සඳහා ඉලෙක්ට්රෝනයක් එකතු කිරීමත් සමඟ 327.9 kJ/mol ශක්තියක් මුදා හැරේ. මූලද්රව්ය ගණනාවක් සඳහා ඉලෙක්ට්රෝන සම්බන්ධය ශුන්ය හෝ සෘණ ට ආසන්න වන අතර එයින් අදහස් වන්නේ මෙම මූලද්රව්ය සඳහා ස්ථායී ඇනායනයක් නොමැති බවයි.
සාමාන්යයෙන්, විවිධ මූලද්රව්යවල පරමාණු සඳහා ඉලෙක්ට්රෝන සම්බන්ධය ඒවායේ අයනීකරණ ශක්තියේ වැඩි වීමක් සමඟ සමාන්තරව අඩු වේ. කෙසේ වෙතත්, සමහර මූලද්රව්ය යුගල සඳහා ව්යතිරේක පවතී:
පළමු පරමාණුවල කුඩා ප්රමාණයන් සහ ඒවායේ ඇති විශාල ඉලෙක්ට්රෝන-ඉලෙක්ට්රෝන විකර්ෂණය මත පදනම්ව මේ සඳහා පැහැදිලි කිරීමක් කළ හැකිය.
ප්රශ්නය 15.
ප්රශ්නය 16.
තිරස් ආවර්තිතා
තිරස් ආවර්තිතා යනු එක් එක් කාල පරිච්ෙඡ්දය තුළ සරල ද්රව්ය සහ සංයෝගවල ගුණාංගවල උපරිම සහ අවම අගයන් වල පෙනුමෙන් සමන්විත වේ. VIIIB කාණ්ඩයේ සහ ලැන්තනයිඩවල මූලද්රව්ය සඳහා එය විශේෂයෙන් කැපී පෙනේ (නිදසුනක් ලෙස, ඉරට්ටේ අනුක්රමික අංක සහිත ලැන්තනයිඩ ඔත්තේ ඒවාට වඩා බහුලව දක්නට ලැබේ).
අයනීකරණ ශක්තිය සහ ඉලෙක්ට්රෝන සම්බන්ධතාවය වැනි භෞතික ගුණාංගවල තිරස් ආවර්තිතා ද ප්රකාශ වේ, අවසාන ශක්ති උප මට්ටම්වල ඉලෙක්ට්රෝන සංඛ්යාවේ ආවර්තිතා වෙනසක් සමඟ සම්බන්ධ වේ.
කක්ෂීය ක්වොන්ටම් අංකයේ 0 සිට (n-1) දක්වා වෙනස්වීම් වල සීමාවන්ට අනුව, එක් එක් ශක්ති මට්ටම් තුළ දැඩි ලෙස සීමිත උප මට්ටම් සංඛ්යාවක් තිබිය හැකිය, එනම්: උප මට්ටම් ගණන මට්ටම් අංකයට සමාන වේ:
ප්රධාන (n) සහ කාක්ෂික (l) ක්වොන්ටම් සංඛ්යා වල එකතුව ඉලෙක්ට්රෝනයක ශක්තිය සම්පූර්ණයෙන්ම සංලක්ෂිත කරයි.ඉලෙක්ට්රෝනයක ශක්ති සංචිතය එකතුවෙන් (n+l) පරාවර්තනය වේ.
උදාහරණයක් ලෙස, 3d උප මට්ටමේ ඉලෙක්ට්රෝන 4s උප මට්ටමේ ඉලෙක්ට්රෝන වලට වඩා වැඩි ශක්තියක් ඇත:
පරමාණුවක මට්ටම් සහ උප මට්ටම් ඉලෙක්ට්රෝන වලින් පුරවා ඇති අනුපිළිවෙල අනුව තීරණය වේ රීතිය V.M. ක්ලෙච්කොව්ස්කි:පරමාණුවේ ඉලෙක්ට්රොනික මට්ටම් පිරවීම අනුක්රමයෙන් සිදුවන්නේ එකතුව (n + 1) වැඩි කිරීමේ අනුපිළිවෙලටය.
මෙයට අනුකූලව, සියලුම පරමාණුවල ඉලෙක්ට්රෝන කවච ගොඩනගා ඇති උප මට්ටම්වල සැබෑ ශක්ති පරිමාණය තීරණය වේ:
1s ï 2s2p ï 3s3p ï 4s3d4p ï 5s4d5p ï 6s4f5d6p ï 7s5f6d…
3. චුම්බක ක්වොන්ටම් අංකය (m l)අභ්යවකාශයේ ඉලෙක්ට්රෝන වළාකුලේ (කක්ෂීය) දිශාව සංලක්ෂිත කරයි.
ඉලෙක්ට්රෝන වලාකුළේ හැඩය වඩාත් සංකීර්ණ වන තරමට (එනම්, l හි අගය වැඩි වන තරමට), මෙම වලාකුළේ අභ්යවකාශයේ දිශානතියේ වැඩි වෙනස්කම් සහ ඉලෙක්ට්රෝනයේ තනි ශක්ති තත්ත්වයන් පවතින අතර, එය චුම්බකයේ නිශ්චිත අගයකින් සංලක්ෂිත වේ. ක්වොන්ටම් අංකය.
ගණිතමය වශයෙන් එම් එල් 0 ඇතුළුව -1 සිට +1 දක්වා පූර්ණ අගයන් ගනී, i.e. මුළු (21+1) අගයන්.
අපි අභ්යවකාශයේ ඇති එක් එක් පරමාණුක කාක්ෂික ශක්ති කෝෂයක් ලෙස නම් කරමු, එවිට උප මට්ටමේ ඇති එවැනි සෛල සංඛ්යාව වනුයේ:
| උප මට්ටමේ | විය හැකි අගයන් m එල් | උප මට්ටමේ තනි තනි ශක්ති අවස්ථා ගණන (කක්ෂ, සෛල). | |
| s (l=0) | එක | ||
| p (l=1) | -1, 0, +1 | තුන් | |
| d (l=2) | -2, -1, 0, +1, +2 | පහ | |
| f (l=3) | -3, -2, -1, 0, +1, +2, +3 | හත | |
නිදසුනක් ලෙස, ගෝලාකාර s-කක්ෂයක් අභ්යවකාශයේ අද්විතීය ලෙස යොමු කෙරේ. එක් එක් p-sublevel හි Dumbbell-හැඩැති කාක්ෂික ඛණ්ඩාංක අක්ෂ තුනක් ඔස්සේ දිශානුගත වේ.
4. ස්පින් ක්වොන්ටම් අංකය m sඉලෙක්ට්රෝනය එහි අක්ෂය වටා භ්රමණය වීම සංලක්ෂිත කරන අතර අගයන් දෙකක් පමණක් ගනී: + 1 / 2 සහ - 1 / 2, එක් දිශාවකට හෝ වෙනත් දිශාවකට භ්රමණය වන දිශාව අනුව. Pauli මූලධර්මයට අනුව, ප්රතිවිරුද්ධ දිශාවකින් යුත් (ප්රතිසමාන්තර) එක් කක්ෂයක ඉලෙක්ට්රෝන 2කට වඩා ස්ථානගත කළ නොහැක.
p-උප මට්ටමේ භ්රමණය:.
එවැනි ඉලෙක්ට්රෝන යුගල ලෙස හැඳින්වේ, යුගල නොකළ ඉලෙක්ට්රෝනයක් ක්රමානුකූලව තනි ඊතලයකින් නිරූපණය කෙරේ: .
එක් කක්ෂයක (ඉලෙක්ට්රෝන 2ක) ධාරිතාව සහ උප මට්ටමේ (m s) ශක්ති තත්ත්ව ගණන දැන ගැනීමෙන්, අපට උප මට්ටමේ ඇති ඉලෙක්ට්රෝන ගණන තීරණය කළ හැක.
ඔබට ප්රතිඵලය වෙනස් ලෙස ලිවිය හැකිය: s 2 p 6 d 10 f 14 .
පරමාණුවේ ඉලෙක්ට්රොනික සූත්ර නිවැරදිව ලිවීම සඳහා මෙම සංඛ්යා හොඳින් මතක තබා ගත යුතුය.
ඉතින්, ක්වොන්ටම් අංක හතරක් - n, l, m l, m s - පරමාණුවක ඇති එක් එක් ඉලෙක්ට්රෝන වල තත්වය සම්පූර්ණයෙන්ම තීරණය කරයි. n හි එකම අගයක් ඇති පරමාණුවක ඇති සියලුම ඉලෙක්ට්රෝන ශක්ති මට්ටමක් සාදයි, n සහ l සමාන අගයන් සහිත - ශක්ති උප මට්ටමක්, n, l සහ m යන අගයන් සමඟම එල්- වෙනම පරමාණුක කාක්ෂික (ක්වොන්ටම් සෛල). එකම කක්ෂයේ ඇති ඉලෙක්ට්රෝන වලට විවිධ භ්රමණයන් ඇත.
ක්වොන්ටම් සංඛ්යා හතරේම අගයන් සැලකිල්ලට ගනිමින්, ශක්ති මට්ටම්වල (ඉලෙක්ට්රොනික ස්ථර) උපරිම ඉලෙක්ට්රෝන ගණන අපි තීරණය කරමු:
ඉලෙක්ට්රෝන විශාල සංඛ්යාවක් (18.32) පරමාණුවල ගැඹුරු ඉලෙක්ට්රෝන ස්ථර වල පමණක් අඩංගු වේ, පිටත ඉලෙක්ට්රෝන ස්ථරයේ 1 (හයිඩ්රජන් සහ ක්ෂාර ලෝහ සඳහා) සිට ඉලෙක්ට්රෝන 8 (නිෂ්ක්රීය වායු) දක්වා අඩංගු විය හැක.
ඉලෙක්ට්රෝන සමඟ ඉලෙක්ට්රෝන කවච පිරවීම අනුව සිදු වන බව මතක තබා ගැනීම වැදගත්ය අවම ශක්තියේ මූලධර්මය: අඩුම ශක්ති අගය සහිත උප මට්ටම් පළමුව පුරවනු ලැබේ, පසුව ඉහළ අගයන් සහිත ඒවා. මෙම අනුපිළිවෙල V.M හි බලශක්ති පරිමාණයට අනුරූප වේ. ක්ලෙච්කොව්ස්කි.
පරමාණුවක ඉලෙක්ට්රොනික ව්යුහය විද්යුත් සූත්ර මගින් ප්රදර්ශනය කෙරෙන අතර එමඟින් ශක්ති මට්ටම්, උප මට්ටම් සහ උප මට්ටමේ ඇති ඉලෙක්ට්රෝන ගණන පෙන්නුම් කරයි.
උදාහරණයක් ලෙස, හයිඩ්රජන් පරමාණු 1 H සතුව ඇත්තේ ඉලෙක්ට්රෝන 1 ක් පමණි, එය න්යෂ්ටියේ සිට පළමු ස්ථරයේ s-sublevel හි පිහිටයි; හයිඩ්රජන් පරමාණුවේ ඉලෙක්ට්රොනික සූත්රය 1s 1 වේ.
ලිතියම් පරමාණු 3 Li හි ඇත්තේ ඉලෙක්ට්රෝන 3ක් පමණක් වන අතර ඉන් 2ක් පළමු ස්ථරයේ s-sublevel හි ඇති අතර 1 දෙවන ස්ථරයේ තැන්පත් කර ඇති අතර එය s-sublevel සමඟද ආරම්භ වේ. ලිතියම් පරමාණුවේ ඉලෙක්ට්රොනික සූත්රය 1s 2 2s 1 වේ.
පොස්පරස් පරමාණු 15 P හි ඉලෙක්ට්රෝන ස්ථර තුනක ඉලෙක්ට්රෝන 15 ක් ඇත. s-sublevel හි ඉලෙක්ට්රෝන 2 කට වඩා නොමැති බවත්, p-sublevel හි 6 ට වඩා වැඩි නොවන බවත් මතක තබා ගනිමින්, අපි ක්රමයෙන් සියලුම ඉලෙක්ට්රෝන උප මට්ටම් වලට තබා පොස්පරස් පරමාණුවේ ඉලෙක්ට්රොනික සූත්රය සකස් කරමු: 1s 2 2s 2 2 2p 6 3s 2 3p 3.
මැංගනීස් පරමාණු 25 Mn හි ඉලෙක්ට්රොනික සූත්රය සම්පාදනය කිරීමේදී, උප මට්ටමේ ශක්තිය වැඩි කිරීමේ අනුපිළිවෙල සැලකිල්ලට ගත යුතුය: 1s2s2p3s3p4s3d…
අපි ක්රමයෙන් සියලුම Mn ඉලෙක්ට්රෝන 25 බෙදා හරිමු: 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 5 .
මැංගනීස් පරමාණුවේ අවසාන ඉලෙක්ට්රොනික සූත්රය (න්යෂ්ටියේ සිට ඉලෙක්ට්රෝන වල දුර සැලකිල්ලට ගනිමින්) මේ ආකාරයට පෙනේ:
| 1s2 | 2s 2 2p 6 | 3s 2 3p 6 3d 5 | 4s 2 |
මැංගනීස් වල ඉලෙක්ට්රොනික සූත්රය ආවර්තිතා පද්ධතියේ එහි පිහිටීමට සම්පූර්ණයෙන්ම අනුරූප වේ: ඉලෙක්ට්රොනික ස්ථර ගණන (ශක්ති මට්ටම්) - 4 කාල සීමාවට සමාන වේ; පිටත ස්ථරයේ ඉලෙක්ට්රෝන 2 ක් ඇත, අවසාන ස්ථරය සම්පූර්ණ කර නැත, එය ද්විතියික උප කාණ්ඩවල ලෝහ සඳහා සාමාන්ය වේ; මුළු ජංගම සංයුජතා ඉලෙක්ට්රෝන ගණන (3d 5 4s 2) - 7 කණ්ඩායම් අංකයට සමාන වේ.
පරමාණු -s-, p-, d- හෝ f- අවසන් වරට ගොඩනගා ඇති ශක්ති උප මට්ටම් මත පදනම්ව, සියලුම රසායනික මූලද්රව්ය ඉලෙක්ට්රොනික පවුල්වලට බෙදා ඇත: s-මූලද්රව්ය(H, He, ක්ෂාර ලෝහ, ආවර්තිතා පද්ධතියේ 2 වන කාණ්ඩයේ ප්රධාන උප කාණ්ඩයේ ලෝහ); p-මූලද්රව්ය(ආවර්තිතා පද්ධතියේ ප්රධාන උප කණ්ඩායම් 3, 4, 5, 6, 7, 8 වන කණ්ඩායම්වල මූලද්රව්ය); d-මූලද්රව්ය(ද්විතියික උප කාණ්ඩවල සියලුම ලෝහ); f-මූලද්රව්ය(ලැන්තනයිඩ සහ ඇක්ටිනයිඩ).
පරමාණුවල ඉලෙක්ට්රොනික ව්යුහයන් යනු ආවර්තිතා පද්ධතියේ ව්යුහය පිළිබඳ ගැඹුරු න්යායික සනාථනයකි, කාල පරිච්ඡේදවල දිග (එනම් කාල පරිච්ඡේදවල ඇති මූලද්රව්ය ගණන) ඉලෙක්ට්රොනික ස්ථරවල ධාරිතාව සහ වැඩිවන ශක්තියේ අනුපිළිවෙල අනුව කෙලින්ම අනුගමනය කරයි. උප මට්ටම්:
සෑම කාල පරිච්ඡේදයක්ම s 1 (ක්ෂාර ලෝහ) පිටත ස්ථර ව්යුහයක් සහිත s-මූලද්රව්යයකින් ආරම්භ වන අතර …s 2 p 6 (නිෂ්ක්රීය වායු) පිටත ස්ථර ව්යුහයක් සහිත p-මූලද්රව්යයකින් අවසන් වේ. 1 වන කාල පරිච්ඡේදයේ අඩංගු වන්නේ s-මූලද්රව්ය දෙකක් පමණි (H සහ He), 2 වන සහ 3 වන කුඩා කාල පරිච්ඡේදවල එක් එක් s-මූලද්රව්ය දෙකක් සහ p-මූලද්රව්ය හයක් අඩංගු වේ. s- සහ p-මූලද්රව්ය අතර 4 වන සහ 5 වැනි විශාල කාල පරිච්ඡේදවලදී, d-මූලද්රව්ය 10 බැගින් “කුඤ්ඤ” - සංක්රාන්ති ලෝහ, පැති උප කාණ්ඩවලට වෙන් කර ඇත. VI සහ VII කාල වකවානුවලදී, තවත් f-මූලද්රව්ය 14ක් ප්රතිසම ව්යුහයට එකතු කරනු ලැබේ, ඒවා පිළිවෙලින් ලැන්තනම් සහ ඇක්ටිනියම් වලට සමාන වන අතර ලැන්තනයිඩ සහ ඇක්ටිනයිඩවල උප කාණ්ඩ ලෙස හුදකලා වේ.
පරමාණුවල ඉලෙක්ට්රොනික ව්යුහයන් අධ්යයනය කරන විට, ඒවායේ ග්රැෆික් නිරූපණය කෙරෙහි අවධානය යොමු කරන්න, උදාහරණයක් ලෙස:
13 Al 1s 2 2s 2 2p 6 3s 2 3p 1
N=2 1s 2s 2p 3s 3p
රූපයේ අනුවාද දෙකම භාවිතා වේ: a) සහ b):
කාක්ෂිකවල ඉලෙක්ට්රෝන නිවැරදිව සකස් කිරීම සඳහා, එය දැන ගැනීම අවශ්ය වේ ගුන්ඩ්ගේ රීතිය:උපමට්ටමේ ඇති ඉලෙක්ට්රෝන ඒවායේ සම්පූර්ණ භ්රමණය උපරිම වන පරිදි සකසා ඇත. වෙනත් වචන වලින් කිවහොත්, ඉලෙක්ට්රෝන මුලින්ම ලබා දී ඇති උප මට්ටමේ සියලුම නිදහස් සෛල එකින් එක අල්ලා ගනී.
උදාහරණයක් ලෙස, සෑම විටම කක්ෂ තුනක් ඇති p-sublevel එකක p-ඉලෙක්ට්රෝන තුනක් (p 3) තැබීමට අවශ්ය නම්, හැකි විකල්ප දෙකෙන්, පළමු විකල්පය Hund ගේ නියමයට අනුරූප වේ:
උදාහරණයක් ලෙස, කාබන් පරමාණුවක චිත්රක ඉලෙක්ට්රොනික පරිපථය සලකා බලන්න:
6 C 1s 2 2s 2 2p 2
පරමාණුවක යුගල නොකළ ඉලෙක්ට්රෝන ගණන ඉතා වැදගත් ලක්ෂණයකි. සහසංයුජ බන්ධන න්යායට අනුව රසායනික බන්ධන සෑදිය හැකි අතර පරමාණුවක සංයුජතා හැකියාවන් තීරණය කළ හැක්කේ යුගල නොකළ ඉලෙක්ට්රෝනවලට පමණි.
උප මට්ටමේ නිදහස් ශක්ති තත්ත්වයන් (අනවසර කාක්ෂික) තිබේ නම්, පරමාණුව, උද්දීපනය මත, "වාෂ්ප", යුගල කරන ලද ඉලෙක්ට්රෝන වෙන් කරයි, සහ එහි සංයුජතා හැකියාවන් වැඩි වේ:
6 C 1s 2 2s 2 2p 3
සාමාන්ය තත්වයේ කාබන් 2-සංයුජතා වේ, උද්වේගකර තත්වයේ දී එය සංයුජතා 4කි. ෆ්ලෝරීන් පරමාණුවට උද්දීපනය සඳහා අවස්ථා නොමැත (බාහිර ඉලෙක්ට්රෝන ස්ථරයේ සියලුම කාක්ෂික වාඩිලාගෙන ඇති බැවින්), එබැවින් එහි සංයෝගවල ෆ්ලෝරීන් ඒක සංයුජ වේ.
උදාහරණ 1ක්වොන්ටම් සංඛ්යා යනු කුමක්ද? ඔවුන්ට ගත හැකි අගයන් මොනවාද?
විසඳුමක්.පරමාණුවක ඉලෙක්ට්රෝනයක චලිතය සම්භාවිතා ස්වභාවයක් ඇත. ඉහළම සම්භාවිතාව (0.9-0.95) සමඟ ඉලෙක්ට්රෝනයක් ස්ථානගත කළ හැකි වටකුරු අවකාශය පරමාණුක කක්ෂය (AO) ලෙස හැඳින්වේ. පරමාණුක කාක්ෂිකයක්, ඕනෑම ජ්යාමිතික රූපයක් මෙන්, ක්වොන්ටම් සංඛ්යා (n, l, m) ලෙස හඳුන්වන පරාමිති තුනකින් (ඛණ්ඩාංක) සංලක්ෂිත වේ. එල්) ක්වොන්ටම් සංඛ්යා කිසිවක් ගන්නේ නැත, නමුත් නිශ්චිත, විවික්ත (අඛණ්ඩ) අගයන් ගනී. ක්වොන්ටම් සංඛ්යා වල අසල්වැසි අගයන් එකකින් වෙනස් වේ. ක්වොන්ටම් සංඛ්යා අභ්යවකාශයේ ඇති පරමාණුක කක්ෂයක ප්රමාණය (n), හැඩය (l) සහ දිශානතිය (m l) තීරණය කරයි. එක් හෝ තවත් පරමාණුක කාක්ෂිකයක් අල්ලාගෙන, ඉලෙක්ට්රෝනයක් ඉලෙක්ට්රෝන වලාකුළක් සාදයි, එම පරමාණුවේ ඉලෙක්ට්රෝන සඳහා වෙනස් හැඩයක් තිබිය හැකිය (රූපය 1). ඉලෙක්ට්රෝන වලාකුළු වල ආකාර AO වලට සමාන වේ. ඒවා ඉලෙක්ට්රෝන හෝ පරමාණුක කාක්ෂික ලෙසද හැඳින්වේ. ඉලෙක්ට්රෝන වලාකුළ අංක හතරකින් සංලක්ෂිත වේ (n, l, m 1 සහ m 5).