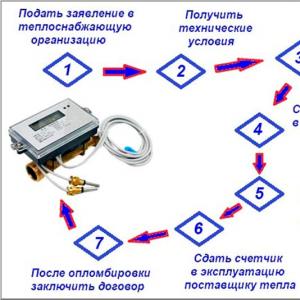
Сірий елемент Менделєєва таблиці. Характеристика сірки. Застосування сірки. Медичні сірки. Можливо, це вас зацікавить
Сірка(Лат. Sulfur) S, хімічний елемент VI групи періодичної системи Менделєєва; атомний номер 16, атомна маса 32,06. Природна С. складається із чотирьох стабільних ізотопів: 32 S (95,02%), 33 S (0,75%), 34 S (4,21%), 36 S (0,02%). Отримано також штучні радіоактивні ізотопи 31 S ( T 1/2 = 2,4 сік), 35 S ( T 1/2 = 87,1 cym), 37 S ( T 1/2 = 5,04 хв).
Історична довідка. С. у самородному стані, а також у вигляді сірчистих сполук відома з найдавніших часів. Вона згадується в Біблії, поемах Гомера та ін. С. входила до складу "священних" куріння при релігійних обрядах; вважалося, що запах С., що горить, відганяє злих духів. С. давно стала необхідним компонентом запальних сумішей для військових цілей, наприклад "грецького вогню" (10 ст н.е.). Близько 8 ст. у Китаї стали використовувати С. у піротехнічних цілях. Здавна С. та її сполуками лікували шкірні захворювання. У період арабської алхімії виникла гіпотеза, згідно з якою С. (початок горючості) і ртуть (початок металу) вважали складовими частинами всіх металів. Елементарну природу С. встановив А.Л. Лавуазьєі включив їх у список неметалевих простих тіл (1789). У 1822 е. Мічерліхвиявив алотропію С.
Поширення у природі. С. відноситься до дуже поширених хімічних елементів (кларк 4,7-10-2); зустрічається у вільному стані ( сірка самородна) і у вигляді сполук - сульфідів, полісульфідів, сульфатів (див. Сульфіди природні, Сульфати природні, Сульфідні руди). Вода морів та океанів містить сульфати натрію, магнію, кальцію. Відомо понад 200 мінералів С., що утворюються при ендогенних процесах. У біосфері утворюється понад 150 мінералів С. (переважно сульфатів); широко поширені процеси окислення сульфідів до сульфатів, які у свою чергу відновлюються до вторинного H 2 S та сульфідів. Ці реакції відбуваються з участю мікроорганізмів. Багато процесів біосфери призводять до концентрації С. - вона накопичується в гумусі ґрунтів, вугіллі, нафті, морях та океанах (8,9-10 -2 %), підземних водах, в озерах та солончаках. У глинах і сланцях С. у 6 разів більше, ніж у земній корі загалом, у гіпсі – у 200 разів, у підземних сульфатних водах – у десятки разів. У біосфері відбувається кругообіг С.: вона приноситься на материки з атмосферними опадами та повертається в океан зі стоком. Джерелом С. у геологічному минулому Землі служили головним чином продукти виверження вулканів, що містять SO 2 і H 2 S. Господарська діяльність людини прискорила міграцію С.; інтенсифікувалося окиснення сульфідів.
Фізичні та хімічні властивості. С. - тверда кристалічна речовина, стійка у вигляді двох алотропічних модифікацій. Ромбічна a-S лимонно-жовтого кольору, щільність 2,07 г/см 3, tпл 112,8 ° C, стійка нижче 95,6 ° C; моноклінна b-S медово-жовтого кольору, щільність 1,96 г/см 3, tпл 119,3 °C, стійка між 95,6 °C та температурою плавлення. Обидві ці форми утворені восьмичленними циклічними молекулами S 8 з енергією зв'язку S - S 225,7 кдж/моль.
При плавленні С. перетворюється на рухливу жовту рідину, яка вище 160 ° C буріє, а близько 190 ° C стає в'язкою темно-коричневою масою. Вище 190°C в'язкість зменшується, а при 300°C Знову стає рідиною. Це зумовлено зміною будови молекул: при 160 °C кільця S 8 починають розриватися, переходячи у відкриті ланцюги; подальше нагрівання вище за 190 °C зменшує середню довжину таких ланцюгів.
Якщо розплавлену С., нагріту до 250-300 ° C, влити тонким струменем в холодну воду, виходить коричнево-жовта пружна маса (пластична С.). Вона лише частково розчиняється в сірковуглецю, в осаді залишається пухкий порошок. Розчинна CS 2 модифікація називається l-S, а нерозчинна - m-S. При кімнатній температурі обидві ці модифікації перетворюються на стійку крихку a-S. t kіп С. 444,6 ° C (одна зі стандартних точок міжнародної температурної шкали). У парах при температурі кипіння, крім молекул S 8 існують також S 6 , S 4 і S 2 . При подальшому нагріванні великі молекули розпадаються, і при 900°C залишаються лише S 2 які приблизно при 1500°C помітно дисоціюють на атоми. При заморожуванні рідким азотом сильно нагрітої пари С. виходить стійка нижче - 80°C пурпурна модифікація, утворена молекулами S 2 .
С. - поганий провідник тепла та електрики. У воді вона практично нерозчинна, добре розчиняється в безводному аміаку, сірковуглецю та в ряді органічних розчинників (фенол, бензол, дихлоретан та ін.).
Конфігурація зовнішніх електронів атома S3 s 2 3p 4. У сполуках С. виявляє ступеня окиснення -2, +4, +6.
С. хімічно активна і особливо легко при нагріванні з'єднується майже з усіма елементами, за винятком N 2 I 2 Au, Pt і інертних газів. СО 2 на повітрі вище 300 °C утворює окисли: SO 2 - сірчистий ангідридта SO 3 - сірчаний ангідрид, з яких отримують відповідно сірчисту кислотуі сірчану кислоту, а також їх солі сульфітиі сульфати(Див. також Тіокислотиі Тіосульфати). Вже на холоді S енергійно з'єднується з F 2 при нагріванні реагує з Cl 2 (див. Сірки фториди, Сірки хлориди); з бромом С. утворює тільки S 2 Br 2 іодиди сірки нестійкі. При нагріванні (150 - 200 °C) настає оборотна реакція з H 2 з отриманням сірчистого водню. С. утворює також багатосірчисті водні загальної формули H 2 S x , т.з. сульфани. Відомі численні сіркоорганічні сполуки.
При нагріванні С. взаємодіє з металами, утворюючи відповідні сірчисті сполуки (сульфіди) та багатосірчисті метали (полісульфіди). При температурі 800-900 ° C пари С. реагують з вуглецем, утворюючи сірковуглець CS 2 . Сполуки С. з азотом (N 4 S 4 і N 2 S 5) можуть бути отримані лише непрямим шляхом.
Отримання. Елементарну С. отримують із сірки самородної, а також окисленням сірчистого водню та відновленням сірчистого ангідриду. Про способи видобутку С. див. Сірчані руди. Джерело сірчистого водню для виробництва С. - коксові, природні гази, гази крекінгу нафти. Розроблено численні методи переробки H2S; найбільше значення мають такі: 1) H 2 S вилучають із газів розчином моногідротіоарсенату натрію:
Na 2 HAsS 2 + H 2 S = Na 2 HAsS 3 O + H 2 O.
Потім продуванням повітря через розчин осаджують С. у вільному вигляді:
NaHAsS 3 O + 1/2 O 2 = Na 2 HAsS 2 O 2 + S.
2) H 2 S виділяють із газів у концентрованому вигляді. Потім його основна маса окислюється киснем повітря до С. та частково до SO 2 . Після охолодження H 2 S і гази, що утворилися (SO 2 , N 2 , CO 2) надходять у два послідовні конвертори, де в присутності каталізатора (активований боксит або спеціально виготовляється алюмогель) відбувається реакція:
2H 2 S + SO 2 = 3S + 2H 2 O.
В основі отримання С. із SO 2 лежить реакція відновлення його вугіллям або природними вуглеводневими газами. Іноді це виробництво поєднується з переробкою піритних руд.
У 1972 р. елементарною С. у світі (без соціалістичних країн) вироблено 32,0 млн. дол. т; Переважна більшість її видобувалася з природних самородних руд. У 70-ті роки. 20 ст. першорядне значення (у зв'язку з відкриттям великих родовищ сірководневмісних паливних газів) набувають методи отримання С. з H 2 S.
Сорта С. Виплавлена безпосередньо із сірчаних руд С. називається природною комовою; отримана з H 2 S та SO 2 - газової комової. Природна комова С., очищена перегонкою, називається рафінованою. Сконденсована з пари при температурі вище точки плавлення в рідкому стані і потім розлита у форми - череневий С. При конденсації С. нижче точки плавлення на стінках конденсаційних камер утворюється дрібний порошок С. - сірчаний колір. Особливо високодисперсна С. називається колоїдною.
Застосування. С. застосовується в першу чергу для отримання сірчаної кислоти: у паперовій промисловості (для отримання сульфітцелюлози); у сільському господарстві (для боротьби з хворобами рослин, головним чином винограду та бавовнику); у гумовій промисловості (вулканізуючий агент); у виробництві барвників і складів, що світяться; для одержання чорного (мисливського) пороху; у виробництві сірників.
І. К. Маліна.
Сірка в організмі. У вигляді органічних та неорганічних сполук С. постійно присутній у всіх живих організмах і є важливим біогенним елементом. Її середній вміст у розрахунку на суху речовину становить: у морських рослинах близько 1,2%, наземних – 0,3%, у морських тварин 0,5-2%, наземних – 0,5%. Біологічна роль С. визначається тим, що вона входить до складу широко розповсюджених у живій природі сполук: амінокислот ( метіонін, цистеїн), і отже білків та пептидів; коферментів ( коферментА, ліпоєва кислота), вітамінів ( біотин, тіамін), глутатіонута інші Сульфгідрильні групи(- SH) залишків цистеїну відіграють важливу роль у структурі та каталітична активність багатьох ферментів. Утворюючи дисульфідні зв'язки (- S - S -) всередині окремих поліпептидних ланцюгів та між ними, ці групи беруть участь у підтримці просторової структури молекул білків. У тварин С. виявлена також у вигляді органічних сульфатів та сульфокислот - хондроїтинсерної кислоти(у хрящах та кістках), таурохолієвої кислоти (у жовчі), гепарину, тауріна. У деяких залізовмісних білках (наприклад, ферродоксинах) С. виявлена у формі сульфіду кислотолабільного. С. здатна до утворення багатих енергією зв'язків у макроергічних сполуках.
Неорганічні сполуки С. в організмах вищих тварин виявлені у невеликих кількостях, головним чином у вигляді сульфатів (у крові, сечі), а також роданідів (у слині, шлунковому соку, молоці, сечі). Морські організми багатші на неорганічні сполуки С., ніж прісноводні та наземні. Для рослин і багатьох мікроорганізмів сульфат (SO 4 2-) поряд з фосфатом і нітратом є найважливішим джерелом мінерального харчування. Перед включенням до органічних сполук С. зазнає змін у валентності і перетворюється потім на органічну форму у своєму найменш окисленому стані; т. о. С. широко бере участь в окисно-відновних реакціях у клітинах. У клітинах сульфати, взаємодіючи з аденозинтрифосфатом (АТФ), перетворюються на активну форму - аденілілсульфат:
фермент, що каталізує цю реакцію, - сульфурилаза (АТФ: сульфат - адснілілтрансфераза) широко поширений в природі. У такій активованій формі сульфонільна група піддається подальшим перетворенням - переноситься на ін. акцептор або відновлюється.
Тварини засвоюють С. у складі органічних сполук. Автотрофні організми отримують всю С., що міститься в клітинах, з неорганічних сполук, головним чином сульфатів. Здібністю до автотрофного засвоєння С. мають вищі рослини, багато водоростей, грибів і бактерій. (З культури бактерій був виділений спеціальний білок, що здійснює перенесення сульфату через клітинну мембрану із середовища в клітину.) Велику роль у кругообігу С. у природі грають мікроорганізми - десульфуруючі бактеріїі серобактерії. Багато родовищ С., що розробляються, - біогенного походження. С. входить до складу антибіотиків ( пеніциліни, цефалоспорини); її з'єднання використовуються як радіозахисних засобів, засоби захисту рослин.
Л. І. Біленький.
Літ.:Довідник сірчанокислотника, під ред. Малина Мал., 2 видавництва, М., 1971; Природна сірка, за ред. М. А. Менковського, М., 1972; Некрасов Би. Ст, Основи загальної хімії, 3 видавництва, т. 1, М., 1973; Ремі Р., Курс неорганічної хімії, пров. з нім., т. 1, М., 1972; Янг Л., Моу Д ж., Метаболізм сполук сірки, пров. з англ., М., 1961; Обрії біохімії, пров. з англ., М., 1964; Біохімія рослин, пров. з англ., М., 1968, гол. 19; Торчинський Ю. М., Сульфгідрильні та дисульфідні групи білків, М., 1971; Деглі С., Нікольсон Д., Метаболічні шляхи, пров. з англ., М., 1973.
Сірка - одна з небагатьох речовин, якими вже кілька тисяч років тому оперували перші хіміки. Вона стала служити людству задовго до того, як зайняла в таблиці Менделєєва клітину № 16.
Про одне з найдавніших (хоч і гіпотетичних!) застосувань сірки розповідають багато старовинних книг. Як джерело тепла при термообробці грішників сірку малюють і Новий і Старий заповіти. І якщо книги такого роду не дають достатніх підстав для археологічних розкопок у пошуках залишків райських кущів або геєни вогненної, то їхнє свідчення про те, що давні були знайомі з сірою та деякими її властивостями, можна прийняти на віру.
Самородна сірка
Однією з причин цієї популярності є поширеність самородної сірки в країнах, найдавніших цивілізацій. Родовища цієї жовтої горючої речовини розроблялися греками та римлянами, особливо в Сицилії, яка аж до кінця минулого століття славилася в основному сірою.
З давніх-давен сірку використовували для релігійно-містичних цілей, її запалювали при різних церемоніях і ритуалах. Але так само давно елемент № 16 придбав і цілком мирські призначення: сірим чорнило зброю, її вживали при виготовленні косметичних та лікарських мазей, її палили для відбілювання тканин і для боротьби з комахами. Видобуток сірки значно збільшився після того, як було винайдено чорний порох. Адже сірка(разом з вугіллям та селітрою) - неодмінний його компонент.
І зараз порохове виробництво споживає частину сірки, що добувається, правда дуже незначну. В наш час сірка - один із найважливіших видів сировинидля багатьох хімічних виробництв. І в цьому причина безперервного зростання світового виробництва сірки.
Великі скупчення самородної сірки зустрічаються не так часто. Найчастіше вона є у деяких рудах. Руда самородної сірки – це порода із вкрапленнями сірки.
Коли утворилися ці вкраплення – одночасно з супутніми породами чи пізніше? Від відповіді це питання залежить напрям пошукових і розвідувальних робіт. Але, незважаючи на тисячоліття спілкування із сіркою, людство досі не має однозначної відповіді. Існує кілька теорій, автори яких дотримуються протилежних поглядів.
Теорія сингенезу (тобто одночасного утворення сірки і порід, що вміщають) припускає, що утворення самородної сірки відбувалося в мілководних басейнах. Особливі бактерії відновлювали сульфати, розчинені у воді, до сірководню, який піднімався вгору, потрапляв до окислювальної зони і тут хімічним шляхом або за участю інших бактерій окислювався до елементної сірки. Сірка осідала на дно, і мул, що згодом містив сірку, утворив руду.
З СТАРОДАВНИХ І СЕРЕДНЬОВІЧНИХ КНИГ.
«Сірка застосовується для очищення жител, оскільки багато хто тримається думки, що запах і горіння сірки можуть захистити від будь-яких чарів і прогнати будь-яку нечисту силу».
Старший Пліній.
"Природна історія". І ст. н.е.
«Якщо трави чахли, бідні соками, а гілки і листя дерев мають забарвлення тьмяне, брудне, темне замість блискучого зеленого кольору, це ознака, що підґрунтя рясніє мінералами, в яких панує сірка».
«Якщо руда дуже багата на сірку, її запалюють на широкому залізному листі з безліччю отворів, через які сірка витікає в горщики, наповнені догори водою».
"Сірка входить також до складу жахливого винаходу - порошку, який може метати далеко вперед шматки заліза, бронзи або каменю - знаряддя війни нового типу".
Агрікола.
"Про царство мінералів". XVI ст.
ЯК ВИПРОБУВАЛИ СІРУ в XIV СТОЛІТТІ. «Якщо ти хочеш випробувати сірку, хороша вона чи ні, то візьми шматок сірки в руку і піднеси до вуха. Якщо сірка тріщить так, що ти чуєш її тріск, значить вона гарна; якщо ж сірка мовчить і не тріщить, то вона погана...»
Цей своєрідний метод визначення якості матеріалу на слух (стосовно сірки) може бути використаний і зараз. Експериментально підтвердилося, що «тріщить» лише сірка, що містить не більше одного відсотка домішок. Іноді справа не обмежується лише тріском – шматок сірки розколюється на частини.
ДУХАЮЧИЙ СІРНИЙ ГАЗ. Як відомо, видатний дослідник давнини Пліній Старший загинув у 79 р. н.е. під час виверження вулкана. Його племінник у листі історику Тациту писав: «... Раптом пролунали гуркіт грому, і від гірського полум'я покотилися вниз чорні сірчані пари. Усі розбіглися. Пліній підвівся і, спираючись на двох рабів, теж думав піти; але смертоносна пара оточила його з усіх боків, його коліна підігнулися, він знову впав і задихнувся».
«Чорні сірчані пари», що занапастили Плінія, складалися, звичайно, не тільки з пароподібної сірки. До складу вулканічних газів входять і сірководень, і двоокис сірки. Ці гази мають не тільки різкий запах, але й велику токсичність. Особливо небезпечний сірководень. У чистому вигляді він вбиває людину майже миттєво. Небезпека велика навіть за незначного (порядку 0,01%) вмісту сірководню в повітрі. Сірководень тим більше небезпечний, що він може накопичуватися в організмі. Він з'єднується із залізом, що входить до складу гемоглобіну, що може призвести до важкого кисневого голодування та смерті. Сірчистий газ (двоокис сірки) менш токсичний, проте випуск його в атмосферу призводив до того, що довкола металургійних заводів гинула вся рослинність. Тому на всіх підприємствах, які виробляють чи використовують ці гази, питанням техніки безпеки приділяється особлива увага.
Сірчистий газ і солом'яний капелюшок. З'єднуючись з водою, сірчистий газ утворює слабку сірчисту кислоту H 2 SO 3 наявну тільки в розчинах. У присутності вологи сірчистий газ знебарвлює багато барвників. Ця властивість використовується для відбілювання вовни, шовку, соломи. Але такі сполуки, як правило, не мають великої стійкості, і білі солом'яні капелюшки з часом набувають початкового брудно-жовтого забарвлення.
HE АСБЕСТ, хоч і схожий. Сірчистий ангідрид SO 3 у звичайних умовах є безбарвною дуже летючою рідиною, що кипить при 44,8°С. Тверде він при - 16,8 ° С і стає дуже схожим на звичайний лід. Але є й інша - полімерна модифікація твердого сірчаного ангідриду (формулу його в цьому випадку слід би писати (SO 3) n. Зовні вона дуже схожа на азбест, її волокнисту структуру підтверджують рентгенограми. Строго певної точки плавлення ця модифікація не має, що її неоднорідності.
ГІПС та АЛЕБАСТР. Гіпс CaSO 4 -2H 2 O - один із найпоширеніших мінералів. Але поширені в медичній практиці «гіпсові шипи» виготовляються не з природного гіпсу, а з алебастру. Алебастр відрізняється від гіпсу лише кількістю кристалізаційної води в молекулі, його формула 2CaSO 4 -H 2 O. При "варінні" алебастру (процес йде при 160-170°С протягом 1,5-2 годин) гіпс втрачає три чверті кристалізаційної води, і матеріал набуває в'яжучих властивостей. Алебастр жадібно захоплює воду, при цьому відбувається швидка безладна кристалізація. Розрости кристали не встигають, але сплітаються один з одним; маса, утворена ними, у найдрібніших подробицях відтворює форму, в якій відбувається твердіння. Хімізм процесу, що відбувається в цей час, обернений тому, що відбувається при варінні: алебастр перетворюється на гіпс. Тому відливка – гіпсова, маска – гіпсова, пов'язка – теж гіпсова, а робляться вони з алебастру.
ГЛАУБЕРОВА СІЛЬ. Сіль Na 2 SO 4 *10H 2 O, відкрита найбільшим німецьким хіміком XVII ст. Йоганном Рудольфом Глаубером і названа на його честь, досі широко застосовується в медицині, склоробстві, кристалографічних дослідженнях. Глаубер так описував її: «Ця сіль, якщо вона добре приготовлена, має вигляд льоду; вона утворює довгі, зовсім прозорі кристали, які розтоплюються мовою, як лід. Має смак звичайної солі, без жодної їдкості. Кинута на палаючі вугілля, вона не розтріскується з шумом, як звичайна кухонна сіль, і не спалахує з вибухом, як селітра. Вона без запаху та виносить будь-який ступінь жару. Її можна використовувати з вигодою в медицині як зовні, так і всередину. Вона загоює свіжі рани, не дратуючи їх. Це чудові внутрішні ліки: будучи розчинена у воді і дана хворому, вона очищає кишки».
Мінерал глауберової солі називається мірабілітом (від латинського «mimbilis» - дивовижний). Назва походить від імені, яке дав Глаубер відкритої солі; він назвав її чудовою. Найбільше у світі розробки цієї речовини знаходяться в нашій країні, надзвичайно багата на глауберову сіллю вода знаменитої затоки (тепер озера) Кара-Богаз-Гол.
СУЛЬФІТИ, СУЛЬФАТИ, ТІОСУЛЬФАТИ... Якщо ви фотолюбитель, вам необхідний фіксаж, тобто натрієва сіль сіркуватої (тіосерної) кислоти H 2 S 2 O 3 . Тіосульфат натрію Na2S2O3 (він же гіпосульфіт) був поглиначем хлору в перших протигазах. Якщо ви порізалися під час гоління, кров можна зупинити кристалом алюмокалієвих галунів KAl(SO 4) 2 -12H 2 O. Якщо ви хочете побілити стелі, покрити міддю якийсь предмет або знищити шкідників у саду - вам не обійтися без темносиних кристалів мідного купоросу CuSO 4 *5H 2 O. Якщо лікарі порекомендували вам очистити шлунок, скористайтеся гіркою сіллю MgSO4. (Вона ж надає гіркого смаку морській воді.)
Широко використовуються також залізний купорос FeSO 4 *7H2O, хромові галун K 2 SO 4 Cr 2 (SO 4) 3 *2H 2 O і багато інших солі сірчаної, сірчистої та тіосерної кислот.
КІНОВАР. Якщо в лабораторії розлили (виникла небезпека отруєння ртутними парами!), її насамперед збирають, а ті місця, з яких сріблясті краплі не виймаються, засипають порошкоподібною сіркою. Ртуть і сірка вступають у реакцію навіть у твердому стані – при простому зіткненні. Утворюється цегляно-червона кіновар - сульфід ртуті - хімічно вкрай інертна та нешкідлива речовина. Виділити ртуть із кіноварі нескладно. Багато інших металів, зокрема залізо, витісняють ртуть із кіноварі.
СЕРОБАКТЕРІЇ. У природі поступово відбувається кругообіг сірки, подібний до кругообігу азоту або вуглецю. Рослини споживають сірку – адже її атоми входять до складу білка. Рослини беруть сірку з розчинних сульфатів, а гнильні бактерії перетворюють сірку білків на сірководень (звідси - огидний запах гниття). Але є так звані серобактерії, яким взагалі не потрібна органічна їжа. Вони харчуються сірководнем, і в їх організмах в результаті реакції між H 2 S, CO 2 і O 2 утворюються вуглеводи та сірка елементна. Серобактерії нерідко виявляються переповненими крупинками сірки - майже всю їхню масу складає сірка з дуже невеликою «добавкою» органічних речовин.
СЕРА - ФАРМАЦЕВТАМ. Усі сульфамідні препарати – сульфідин, сульфазол, норсульфазол, сульгін, сульфадимезин, стрептоцид та інші пригнічують активність численних мікробів. І всі ці ліки – органічні сполуки сірки. Після появи антибіотиків роль сульфамідних препаратів дещо зменшилась. Втім, і багато антибіотиків можна розглядати як органічні похідні сірки. Зокрема, вона обов'язково входить до складу пеніциліну.
Дрібнодисперсна елементна сірка - основа мазей, що застосовуються при лікуванні грибкових захворювань шкіри.
ЩО МОЖНА ПОБУДУВАТИ З СІРИ. У 70-х роках у деяких країнах світу виробництво сірки перевищило потреби у ній. Тому сірці почали шукати нові застосування, насамперед у таких матеріаломістких сферах, як будівництво. В результаті цих пошуків з'явилися сірчаний пінопласт – як теплоізоляційний матеріал, бетонні суміші, в яких сіркою частково або повністю замінено портландцемент, покриття для автострад, що містять елементну сірку.
ЧОРНА СІРА. З'єднання незвичайного складу S 4 N 4 отримано американськими хіміками наприкінці 70-х. Ця речовина виходила при взаємодії безводного аміаку з одним із хлоридів сірки. З'єднання - надзвичайно нестійке, що розкладається з вибухом, і зберігають його або при дуже високому тиску, або під шаром бензолу. У цих оранжево-червоних кристалах виявили чорні прожилки, які, як виявилося, складаються з елементної сірки. Чорна сірка з тетранітриду виявилася новою алотропною модифікацією давно відомої простої речовини.
НЕМЕТАЛ - МЕТАЛ. У 1980 р. журнал "Листи в ЖЕТФ" опублікував повідомлення про те, що сірка при високому тиску може переходити в металевий і навіть надпровідний стан.
Сірка - хімічний елемент, що розташовується в періодичній системі Менделєєва під номером 16 і позначається символом S (від лат. sulfur). Елементарна природа сірки була встановлена в 1777 році французьким вченим і хіміком Антуаном Лавуазьє. Сірка закипає при температурі 444 градусів за Цельсієм. При плавці переходить з твердого стану в рідке, поступово змінюючи своє забарвлення, залежно від градації температури плавлення. Наприклад, досягаючи позначки 160 градусів Цельсія, цей хімічний елемент змінює своє забарвлення з жовтого кольору на бурий, а нагріваючись до позначки 190 градусів – колір змінюється на темно-коричневий. Досягаючи температурного режиму 190 градусів, сірка втрачає в'язкість структури, потроху стаючи більш рідкою. Остаточно рідкий елемент стає при нагріванні його до 300 градусів.
Крім можливості переходити з твердого стану в рідке сірка має низку інших цікавих особливостей. Так, вона має негативну теплопровідність і не проводить електричний струм. Абсолютно не розчиняється у воді, проте відмінно розчиняється у рідинах, які не мають у своїй структурі молекул води (наприклад, в аміаку). Добре взаємодіє з розчинниками та сірковуглецем, які характеризуються органічною природою. Також, до опису сульфуру можна додати її хімічну особливість. За своєю природою сірка активна і може відмінно вступати в хімічну реакцію при нагріванні з будь-яким хімічним елементом. Може взаємодіяти з такими речовинами як:
- - При кімнатній температурі, вступає з нею в реакцію;
- з металами - створює сульфіди і є водночас окислювачем;
- кисень – нагріваючись до температурної позначки 280 градусів Цельсія, утворює об'єднання оксидів;
- фтор – у тандемі із цією речовиною, сірка показує себе як відновник;
- фосфор або вуглець – в умовах відсутності подачі повітря сірка показує себе як окислювач.
Історичні відомості
Хімічний елемент сірка у своєму самородному стані або у вигляді сірчистих сполук, була відома людству ще багато тисяч років тому. Її унікальні властивості згадуються не лише на священних сторінках Біблії та Тори, а й у поемах Гомера та інших джерелах. Завдяки своїм властивостям сірку використовували при всіляких ритуальних та релігійних обрядах. Сірка була одним із важливих компонентів «священних» курінь, які використовували як для вигнання духів, так і для їхнього заклику. Її використовували щоб «одурманювати тих, хто прийшов», використовуючи сірку в поєднанні з ртуттю, стародавні шамани вважали, що в палаючому стані вона здатна відштовхувати і виганяти демонів, духів та іншу нечисту силу.
Сірка стала невід'ємною часткою у створенні та використанні «грецького вогню», що застосовується у створенні запальних сумішей для військових цілей. У Китаї, близько 8 століття, сірку використовували як піротехнічний засіб, її точну формулу тримали під забороною, її поширення каралося смертною карою.
Існувала думка, що сірка (як початок горючості) і ртуть (як символ початку металічності) є основними складовими всіх металів. Така гіпотеза мала місце в арабській алхімії.
Крім того, Сірий тривалий час лікували шкірні захворювання, вважаючи такий метод найефективнішим у медицині.
Застосування сірки
Сфера застосування сірки достатня багатогранна та різноманітна. Насамперед сірка використовується в хімічній промисловості для створення сірчаної кислоти; у сільському господарстві (для створення засобів, що допомагають у боротьбі зі шкідниками та хворобами рослин, в основному винограду та бавовнику). Знайшла своє застосування сірка також у виробництві гуми, вона використовується при виготовленні сірників, входить до складу барвників та люмінесцентних складів. У медицині сірку використовують у грязьових ваннах; так звана бальнеотерапія (від латинського «замочувати у воді») – допомагає у лікуванні артриту та шкірних захворювань. Науково не доведено, але також сірку застосовують для лікування астми, хоча багато вчених вважають, що саме пари сірки здатні провокувати появу захворювань дихальних шляхів.
Сірка у продуктах харчування
Сірий багаті такі продукти, як:
- аґрус,
- виноград,
- хлібобулочні вироби,
- часник,
- спаржа,
- капуста,
- пісна яловичина,
- курячі яйця,
- молочні продукти,
- злакові культури тощо.
Нестача сірки в організмі
Нестача сірки в організмі людини (при добовій нормі споживання в 4-6 мг) проявляється у вигляді таких захворювань як:
- випадання волосся або повне облисіння,
- хвороби нирок,
- різні алергії,
- тьмяність і ламкість волосся,
- болі в суглобах,
- запори,
- ламкість нігтів,
- тахікардія.
Цікаві та пізнавальні факти про сірку
Сірка є найважливішим елементом в організмі людини, оскільки бере участь у будові клітин, хрящової тканини, нервових волокон. Також бере участь у обмінних процесах. Показує себе як відмінний стабілізатор роботи та координації нервової системи. Сульфур врівноважує рівень цукру в крові, що дуже корисно для людей, які страждають від діабету.
Сірка зменшує біль у суглобах і хрящах, допомагає виводити жовч. Також має на організм протизапальний ефект, використовується для регенерації тканин. Допомагає зміцненню м'язової тканини організму, що росте.
Сама по собі сірка не має запаху, проте при поєднанні з іншими компонентами виділяє запах яєць, що протухли.
Як ми бачимо, така непомітна і звичайна на перший погляд сірка є незамінним компонентом у повноцінному житті людини завдяки своєму широкому спектру застосування. Без сірки, наше життя втратило свої блага, здоров'я стало б не таким міцним.
| S | 16 |
Сірка |
|||||||
| t o кіп. (o С) | 444,674 | Степ.окис. | -2 +4 +6 | ||||||
|
32,066 |
t o плав.(o З) | 119,3 | густина | 2070(a) 1960(b) | |||||
| 3s 2 3p 4 | ОЕО | 2,60 | у зем. корі | 0,052 % | |||||
Сірка — одна з небагатьох речовин, якими вже кілька тисяч років тому оперували перші «хіміки». Вона стала служити людству задовго до того, як зайняла у таблиці Менделєєва клітину під № 16.
Про одне з найдавніших (хоча і гіпотетичних!) застосування сірки розповідають багато старовинних книг. Як джерело тепла при термообробці грішників сірку малюють і Новий і Старий заповіти. І якщо книги такого роду не дають достатньої підстави для археологічних розкопок у пошуках залишків райських кущів або геєни вогняної, то їх свідчення про те, що давні були знайомі з сірою та деякими її властивостями, можна прийняти на віру.
Одна з причин цієї популярності — поширеність самородної сірки в країнах найдавніших цивілізацій. Родовища цієї жовтої паливної речовини розроблялися греками та римлянами, особливо в Сицилії, яка аж до кінця минулого століття славилася переважно сіркою.
З давніх-давен сірку використовували для релігійно-містичних цілей, її запалювали при різних церемоніях і ритуалах. Але так само давно елемент № 16 придбав і цілком мирські призначення: сірого чорнило зброю, її вживали при виготовленні-косметичних і лікарських мазей, її палили для відбілювання тканин і для боротьби з комахами. Видобуток сірки значно збільшився після того, як був винайдений чорний порох. Адже сірка (разом із вугіллям та селітрою)—неодмінний його компонент.
І зараз порохове виробництво споживає частину сірки, що добувається, правда дуже незначну. Нині сірка — одне із найважливіших видів сировини багатьом хімічних виробництв. І це причина безперервного зростання світового виробництва сірки.
Походження сірки
Великі скупчення самородної сірки зустрічаються не так часто. Найчастіше вона є у деяких рудах. Руда самородної сірки це порода з вкрапленнями чистої сірки.
Коли утворилися ці вкраплення — одночасно з супутніми породами чи пізніше? Від відповіді це питання залежить напрям пошукових і розвідувальних робіт. Але, незважаючи на тисячоліття спілкування із сіркою, людство досі не має однозначної відповіді. Існує кілька теорій, автори яких дотримуються протилежних поглядів.
Теорія сингенезу (тобто одночасного утворення сірки і порід, що вміщають) припускає, що утворення самородної сірки відбувалося в мілководних басейнах. Особливі бактерії відновлювали сульфати, розчинені у воді, до сірководню, який піднімався вгору, потрапляв до окислювальної зони і тут хімічним шляхом або за участю інших бактерій окислювався до елементарної сірки. Сірка осідала на дно, і мул, що згодом містив сірку, утворив руду.
Теорія епігенезу (вкраплення сірки утворилися пізніше, ніж основні породи) має кілька варіантів. Найпоширеніший їх передбачає, що підземні води, проникаючи крізь товщі порід, збагачуються сульфатами. Якщо такі води стикаються з родовищами нафти чи газу, то іони сульфатів відновлюються вуглеводнями до сірководню. Сірководень піднімається до поверхні і, окислюючись, виділяє чисту сірку в порожнинах і тріщинах порід.
В останні десятиліття знаходить все нові підтвердження один з різновидів теорії епігенезу - теорія метасоматозу (у перекладі з грецької "метасоматоз" означає заміщення). Відповідно до неї в надрах постійно відбувається перетворення гіпсу CaSO4-H2O та ангідриту CaSО4 на сірку та кальцит СаСО3. Ця теорія створена 1935 року радянськими вченими Л. М. Миропольським та Б. П. Кротовим. На її користь свідчить, зокрема, такий факт.
1961 року в Іраку було відкрито родовище Мішрак. Сірка тут укладена в карбонатних породах, які утворюють склепіння, що підтримується опорами, що йдуть углиб (у геології їх називають крилами). Крила ці складаються в основному з ангідриту та гіпсу. Така сама картина спостерігалася вітчизняному родовищі Шор-Су.
Геологічне своєрідність цих родовищ можна пояснити лише з позицій теорії метасоматозу: первинні гіпси та ангідрити перетворилися на вторинні карбонатні руди із вкрапленнями самородної сірки. Важливим є не тільки сусідство мінералів — середній вміст сірки в руді цих родовищ дорівнює вмісту хімічно зв'язаної сірки в ангідриті. А дослідження ізотопного складу сірки та вуглецю у руді цих родовищ дали прихильникам теорії метасоматозу додаткові аргументи.
Але є одне «але»: хімізм процесу перетворення гіпсу на сірку і кальцит поки не зрозумілий, і тому немає підстав вважати теорію метасоматозу єдино правильною. На землі і зараз існують озера (зокрема, Сірчане озеро поблизу Серноводська), де відбувається сингенетичне відкладення сірки та сіроносний мул не містить пі гіпсу, ані ангідриту.
Все це означає, що розмаїття теорій і гіпотез про походження самородної сірки — результат не тільки не стільки неповноти наших знань, скільки складності явищ, що відбуваються в надрах. Ще з елементарної шкільної математики ми знаємо, що до одного результату можуть призвести різні шляхи. Цей закон поширюється і геохімію.
Видобуток сірки
Сірчані руди видобувають різними способами-залежно від умов залягання. Але в будь-якому випадку доводиться приділяти багато уваги техніці безпеки. Покладам сірки майже завжди супроводжують скупчення отруйних газів - сполук сірки. До того ж не можна забувати про можливість її самозаймання.
Видобуток руди у відкритий спосіб відбувається так. Крокуючі екскаватори знімають пласти порід, під якими залягає руда. Вибухами рудний пласт дроблять, після чого брили руди відправляють на збагачувальну фабрику, а звідти-на сіркоплавильний завод, де з концентрату витягують сірку. Методи вилучення-різні. Про деяких із них буде розказано нижче. А тут доречно коротко описати свердловинний метод видобутку сірки з-під землі, що дозволило Сполученим Штатам Америки та Мексиці стати найбільшими постачальниками сірки.
Наприкінці минулого століття на півдні Сполучених Штатів було відкрито найбагатші родовища сірчаної руди. Але підступитися до пластів було непросто: у шахти (а саме шахтним способом передбачалося розробляти родовище) просочувався сірководень і перегороджував доступ до сірки. Крім того, пробитися до сіроносних пластів заважали піщані плавуни. Вихід знайшов хімік Герман Фраш, який запропонував плавити сірку під землею і через свердловини, подібні до нафтових, викачувати її на поверхню. Порівняно невисока (менше 120 ° С) температура плавлення сірки підтверджувала реальність ідеї Фраша. У 1890 році почалися випробування.
У принципі установка Фраш дуже нескладна: труба в трубі. У простір між трубами подається перегріта вода і йде в пласт. А по внутрішній трубі, що обігрівається з усіх боків, піднімається розплавлена сірка. Сучасний варіант установки Фраш доповнений третьою - найвужчою трубою. Через неї в свердловину подається стиснене повітря, що допомагає підняти розплавлену сірку на поверхню. Однією з основних переваг методу Фраша є те, що він дозволяє вже на першій стадії видобутку отримати порівняно чисту сірку. При створенні багатих руд цей метод дуже ефективний.
Раніше вважалося, що метод підземної виплавки сірки застосовується лише в специфічних умовах «соляних куполів» тихоокеанського узбережжя США та Мексики. Проте досліди, проведені у Польщі та СРСР, спростували цю думку. У народній Польщі цим методом вже видобувають велику кількість сірки; в 1968 році пущені перші сірчані свердловини і в СРСР.
А руду, отриману в кар'єрах та шахтах, доводиться переробляти (часто з попереднім збагаченням), використовуючи при цьому різні технологічні прийоми.
Відомо кілька методів отримання сірки із сірчаних руд: пароводяні, фільтраційні, термічні, центрифугальні та екстракційні.
Термічні методи вилучення сірки - найстаріша. Ще у XVIII столітті в Неаполітанському королівстві виплавляли сірку в купах - "сольфатарах". Досі в Італії виплавляють сірку у примітивних печах – «калькаронах». Тепло, необхідне виплавлення сірки з руди, одержують, спалюючи частину видобутої сірки. Процес цей малоефективний, втрати сягають 45%.
Італія стала батьківщиною та пароводяних методів вилучення сірки з руд. 1859 року Джузеппе Джілль отримав патент на свій апарат — попередник нинішніх автоклавів. Автоклавний метод (значно вдосконалений, звичайно) використовується і зараз у багатьох країнах.
В автоклавному процесі збагачений концентрат сірчаної руди, що містить до 80% сірки, у вигляді рідкої пульпи з реагентами насосами подається в автоклав. Туди ж під тиском подається водяна пара. Пульпа нагрівається до 130 ° С. Сірка, що міститься в концентраті, плавиться і відокремлюється від породи. Після недовгого відстою виплавлена сірка зливається. Потім з автоклава випускаються «хвости» - завись порожньої породи у воді? Хвости містять досить багато сірки і знову надходять на збагачувальну фабрику.
У Росії автоклавний спосіб був вперше застосований інженером К. Г. Паткановим у 1896 році.
Сучасні автоклави – це величезні апарати заввишки з чотириповерховий будинок. Такі автоклави встановлені, зокрема, на сіроплавильному заводі Роздольського гірничохімічного комбінату на Прикарпатті.
На деяких виробництвах, наприклад, на великому сірчаному комбінаті в Тарнобжегу (Польща), порожню породу відокремлюють від розплавленої сірки на спеціальних фільтрах. Метод поділу на спеціальних центрифугах розроблений нещодавно нашій країні. Словом, «руду золоту (точніше — золотисту) відокремлювати від порожньої породи» можна по-різному.
По-різному і задовольняють свої потреби у сірці різні країни. Мексика та США використовують переважно метод Фраша. Італія, що займає з видобутку сірки третє місце серед капіталістичних держав, продовжує видобувати та переробляти (різними методами) сірчані руди сицилійських родовищ та провінції Марко. Японія має значні запаси сірки вулканічного походження. Франція та Канада, які не мають самородної сірки, розвинули велике виробництво, її з газів. Немає власних сірчаних родовищ і в Англії та Німеччині. Свої потреби в сірчаній кислоті вони покривають за рахунок переробки сировини, що містить сировину (переважно піриту), а елементарну сірку імпортують.
Росія повністю задовольняють свої потреби завдяки джерелам сировини. Після відкриття та освоєння багатих Прикарпатських родовищ СРСР та Польща значно збільшили виробництво сірки. Ця галузь промисловості продовжує розвиватись. Було побудовано нові великі підприємства в Україні, реконструйовано старі комбінати на Волзі та в Туркменії, розширено виробництво сірки з природного газу та газів, що відходять.
Кристали в макромолекули
У тому, що сірка-самостійний хімічний елемент, а не сполука, першим переконався великий французький хімік Антуан Лоран Лавуазьє у XVIII столітті.
З тих пір уявлення про сірку як елемент змінилися не дуже сильно, але значно поглибилися і доповнились.
Зараз відомо, що елемент № 16 складається із суміші чотирьох стійких ізотопів з масовими числами 32, 33, 34 та 36. Це типовий неметал.
Лимонно-жовті кристали чистої сірки напівпрозорі. Форма кристалів який завжди однакова. Найчастіше зустрічається ромбічна сірка (найстійкіша модифікація) — кристали мають вигляд октаедрів зі зрізаними кутами. У цю модифікацію за кімнатної (або близької до кімнатної) температури перетворюються всі інші модифікації. Відомо, наприклад, що з кристалізації з раплаву (температура плавлення сірки 119,5° З) спочатку виходять голчасті кристали (моноклинна форма). Але ця модифікація нестійка, і за температури нижче 95,6° З вона перетворюється на ромбічну. Подібний процес відбувається і з іншими модифікаціями сірки.
Нагадаємо відомий досвід – отримання пластичної сірки.
Якщо розплавлену сірку вилити холодну воду, утворюється еластична, багато в чому схожа на гуму маса. Її можна отримати і у вигляді ниток. Але минає кілька днів, і маса перекристалізується, стає жорсткою та ламкою.
Молекули кристалів сірки завжди складаються з восьми атомів (S8), а відмінність у властивостях модифікацій сірки пояснюється поліморфізмом - неоднаковою будовою кристалів. Атоми в молекулі сірки збудовані в замкнутий цикл
S-S-S
S-S-S
При плавленні зв'язку в циклі рвуться, і циклічні молекули перетворюються на лінійні.
Незвичайному поведінці сер при плавленні даються різні тлумачення. Одне з них таке. При температурі від 155 до 187°, мабуть, відбувається значне зростання молекулярної ваги, що підтверджується багаторазовим збільшенням в'язкості. При 187° З в'язкість розплаву досягає майже тисячі пуаз, виходить майже тверда речовина. Подальше зростання температури призводить до зменшення в'язкості (молекулярна вага падає). При 300 ° С сірка знову переходить у текучий стан, а при 444,6 ° С закипає.
У парів сірки з підвищенням температури кількість атомів у молекулі поступово зменшується:
S8 -> S6 -> S4 -> S2. При 1700 ° С пари сірки одноатомні.
Коротко про сполуки сірки
За поширеністю елемент № 16 займає -15-е місце. Вміст сірки у земній корі становить 0,05% за вагою. Це не мало.
До того ж сірка хімічно активна і вступає в реакції з більшістю елементів. Тому в природі сірка зустрічається не тільки у вільному стані, але і у вигляді різноманітних неорганічних сполук. заліза, міді, цинку, свинцю) Сірка є і вугілля, сланців, нафти, природних газів, в організмах тварин і рослин.
При взаємодії сірки з металами зазвичай виділяється досить багато тепла. У реакціях з киснем сірка дає кілька оксидів, з них найважливіші SО2 та SО3 — ангідриди сірчистої Н2SО3 та сірчаної Н2SО4 кислот. Сполука сірки з воднем - сірководень Н2S - дуже отруйний, смердючий газ, який завжди є в місцях гниття органічних залишків. Земна
кора в місцях, розташованих поблизу родовищ сірки, часто містить досить значну кількість сірководню. У водному розчині цей газ має кислотні властивості. Зберігати його розчини на повітрі не можна, він окислюється з виділенням сірки:
2H2S + О2 = 2Н2О + 2S.
Сірководень – сильний відновник. Цією його властивістю користуються у багатьох хімічних виробництвах.
Для чого потрібна сірка
Серед речей, що оточують нас, мало таких, для виготовлення яких не потрібні були б сірка та її сполуки. Папір та гума, ебоніт та сірники, тканини та ліки, косметика та пластмаси, вибухівка та фарба, добрива та отрутохімікати – ось далеко не повний перелік речей та речовин, для виробництва яких потрібен елемент № 16. Для того щоб виготовити, наприклад, автомобіль, потрібно витратити близько 14 кг сірки. Можна без перебільшення сказати, що промисловий потенціал країни досить точно визначається споживанням сірки.
Значну частину світового видобутку сірки поглинає паперова промисловість (з'єднання сірки допомагають виділити целюлозу). Для того, щоб зробити одну тонну целюлози, потрібно витратити більше 100 кг сірки. Багато елементарної сірки споживає і гумова промисловість для вулканізації каучуків.
У сільське господарство сірка застосовується як і елементарному вигляді, і у різних сполуках. Вона входить до складу мінеральних добрив та препаратів для боротьби зі шкідниками. Поряд із фосфором, калієм та іншими елементами сірка необхідна рослинам. Втім, велика частина сірки, що вноситься в грунт, не засвоюється ними, але допомагає засвоювати фосфор. Сірку вводять у ґрунт разом із фосфоритним борошном. Наявні в грунті бактерії окислюють її, утворюються сірчана та сірчиста кислоти реагують з фосфоритами, і в результаті виходять фосфорні сполуки, що добре засвоюються рослинами.
Однак основний споживач сірки – хімічна промисловість. Приблизно половина сірки, що видобувається у світі, йде на виробництво сірчаної кислоти. Щоб отримати одну тонну H2SO4, потрібно спалити близько 300 кг сірки. А роль сірчаної кислоти: у хімічній промисловості можна порівняти з роллю хліба в нашому харчуванні.
Значна кількість сірки (і сірчаної кислоти) витрачається під час виробництва вибухових речовин та сірників. Чиста» звільнена від домішок сірка потрібна для виробництва барвників і складів, що світяться.
Сполуки сірки знаходять застосування у нафтохімічній промисловості. Зокрема, вони необхідні при. -виробництві антидетонаторів, мастильних речовин для апаратури надвисоких тисків; в охолоджуючих оліях, що прискорюють обробку металу, міститься іноді до 18% сірки.
Перелік прикладів, що підтверджують першорядну важливість елемента № 16, можна було б продовжити, але «не можна осягнути неосяжне». Тому мимохіть згадаємо, що сірка необхідна і таким галузям промисловості, як гірничодобувна, харчова, текстильна, і поставимо крапку.
* * *
Наше століття вважається століттям «екзотичних» матеріалів — трансуранових елементів, титану, напівпровідників тощо. Але зовні невибагливий давно відомий елемент № 16 продовжує залишатися абсолютно необхідним. Підраховано, що у виробництві 88 із 150 найважливіших хімічних продуктів використовують або саму сірку, або її сполуки.
Сірка (англ. Sulfur, франц. Sufre, нім. Schwefel) у самородному стані, а також у вигляді сірчистих сполук відома з найдавніших часів. З запахом сірки, що загоріла, задушливою дією сірчистого газу і огидним запахом сірководню людина познайомилася, ймовірно, ще в доісторичні часи. Саме через ці властивості сірка використовувалася жерцями у складі священних куріння при релігійних обрядах. Сірка вважалася твором надлюдських істот із світу духів чи підземних богів. Дуже давно сірка стала застосовуватися у складі різних горючих сумішей для військових цілей. Вже у Гомера описані "сірчисті випари", смертельна дія виділень сірки, що горить. Сірка, ймовірно, входила до складу "грецького вогню", що наводило жах на супротивників. Близько VIII ст. китайці почали використовувати її в піротехнічних сумішах, зокрема, суміші типу пороху. Займистість сірки, легкість, з якою вона з'єднується з металами з утворенням сульфідів (наприклад, на поверхні шматків металу), пояснюють те, що її вважали "принципом горючості" та обов'язковою складовою металевих руд. Пресвітер Теофіл (XI ст.) описує спосіб окислювального випалу сульфідної мідної руди, відомий, ймовірно, ще в стародавньому Єгипті. У період арабської алхімії виникла ртутно-сірчана теорія складу металів, за якою сірка вважалася обов'язковою складовою (батьком) всіх металів. Надалі вона стала одним із трьох принципів алхіміків, а пізніше "принцип горючості" став основою теорії флогістону. Елементарну природу сірки встановив Лавуазьє у своїх дослідах зі спалювання. З введенням пороху в Європі почався розвиток видобутку природної сірки, а також розробка способу одержання її з піритів; останній був поширений у Стародавній Русі. Вперше у літературі він описаний у Агріколи. Походження латів. Sulfur неясно. Вважають, що ця назва запозичена від греків. У літературі алхімічного періоду сірка часто фігурує під різними таємними назвами. У Руланда можна знайти, наприклад, назви Zarnec (пояснення "яйця з вогнем"), Thucios (жива сірка), Terra foetida, spiritus foetens, Scorith, Pater та ін. Давньоруська назва "сірка" використовується вже дуже давно. Під ним малися на увазі різні горючі і погано пахнучі речовини, смоли, фізіологічні виділення (сірка у вухах та ін.). Очевидно, ця назва походить від санскритського сіра (світло-жовтий). З ним пов'язане слово "сірий", тобто невизначеного кольору, що, зокрема, відноситься до смол. Друга давньоруська назва сірки - жупел (сірка палива) - також містить у собі поняття не тільки горючості, а й поганого запаху. Як пояснюють філологи, нім. Schwefel має санскритський корінь swep (спати, англо-саксонське sweblan – вбивати), що, можливо, пов'язане з отруйними властивостями сірчистого газу.