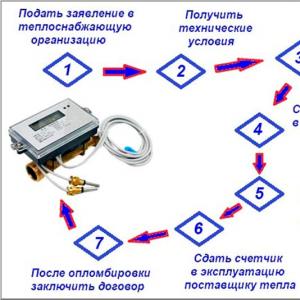
Ямар бодисууд нь органик вэ. Үндсэн ангиллын органик нэгдлүүдийн ерөнхий томъёо
Хамгийн энгийн ангилал бол бүх мэдэгдэж буй бодисууд хуваагддаг органик бус ба органик. Органик бодисууд нь нүүрсустөрөгчба тэдгээрийн деривативууд. Бусад бүх бодисууд нь органик бус байдаг.

органик бус бодисууднайрлагаар нь хуваана энгийн бөгөөд төвөгтэй.

Энгийн бодисууднэг химийн элементийн атомуудаас бүрдэх ба металл, металл бус, үнэт хий гэж хуваагддаг. Нэгдлүүд нь атомуудаас бүрддэг өөр өөр элементүүдөөр хоорондоо химийн холбоотой.
Органик бус нийлмэл бодисыг найрлага, шинж чанараараа дараах үндсэн ангилалд хуваана. исэл, суурь, хүчил, амфотерийн гидроксид, давс.
- ислүүд- энэ бол нарийн төвөгтэй бодисууд, хоёроос бүрдэнэ химийн элементүүд, тэдгээрийн нэг нь (-2) исэлдэлтийн төлөвтэй хүчилтөрөгч юм. Оксидын ерөнхий томъёо нь: E m O n, энд m нь E элементийн атомын тоо, n нь хүчилтөрөгчийн атомын тоо юм. Оксидыг эргээд давс үүсгэдэг ба давс үүсгэдэггүй гэж ангилдаг. Давс үүсгэдэг бодисууд нь суурь, амфотерийн гидроксид, хүчил зэрэгт тохирсон үндсэн, амфотер, хүчиллэг гэж хуваагддаг.
- Үндсэн оксидууднь +1 ба +2 исэлдэлтийн төлөвт байгаа металлын исэл юм. Үүнд:
- нэгдүгээр бүлгийн үндсэн дэд бүлгийн металлын исэл ( шүлтлэг металлууд ) Li-Fr
- хоёрдугаар бүлгийн үндсэн дэд бүлгийн металлын исэл ( Mg ба шүлтлэг шороон металлууд) Mg-Ra
- исэлдэлтийн доод төлөвт шилжилтийн металлын исэл
- Хүчиллэг исэл- S.O-тай металл бус бодис үүсгэдэг. +2-оос дээш ба металлууд нь S.O. +5-аас +7 хүртэл (SO 2, SeO 2, P 2 O 5, As 2 O 3, CO 2, SiO 2, CrO 3 ба Mn 2 O 7). Үл хамаарах зүйл: NO оксидын хувьд 2 болон ClO 2 харгалзах хүчиллэг гидроксид байхгүй боловч тэдгээрийг хүчиллэг гэж үздэг.
- Амфотерийн исэл-амфотер металлаар үүсгэгдсэн S.O. +2, +3, +4 (BeO, Cr 2 O 3, ZnO, Al 2 O 3, GeO 2, SnO 2 ба PbO).
- Давс үүсгэдэггүй исэл- С.О.+1, +2 (СО, NO, N 2 O, SiO) бүхий металл бус исэл.
- Суурь- эдгээр нь металлын атом ба нэг буюу хэд хэдэн гидроксо бүлгээс (-OH) бүрдэх цогц бодисууд юм. Суурийн ерөнхий томъёо нь: M (OH) y, энд y нь M металлын исэлдэлтийн төлөвтэй тэнцүү гидроксо бүлгийн тоо (ихэвчлэн +1 ба +2). Суурь нь уусдаг (шүлт) ба уусдаггүй гэж хуваагддаг.
- хүчил- (хүчиллэг гидроксид) нь металлын атомуудаар орлуулж болох устөрөгчийн атом, хүчиллэг үлдэгдэлээс бүрдэх цогц бодис юм. Хүчлийн ерөнхий томьёо: H x Ac, энд Ac нь хүчиллэг үлдэгдэл (Англи хэлнээс "хүчил" - хүчил), x нь хүчлийн үлдэгдлийн ионы цэнэгтэй тэнцэх устөрөгчийн атомын тоо юм.
- Амфотерийн гидроксидхүчил ба суурийн шинж чанарыг хоёуланг нь харуулдаг нарийн төвөгтэй бодисууд юм. Тиймээс амфотерийн гидроксидын томьёог хүчил ба суурийн хэлбэрээр хоёуланг нь бичиж болно.
- давс- Эдгээр нь металлын катион ба хүчлийн үлдэгдлийн анионуудаас бүрдэх цогц бодис юм. Энэ тодорхойлолт нь дунд зэргийн давсанд хамаарна.
- Дунд зэргийн давс- эдгээр нь хүчлийн молекул дахь устөрөгчийн атомыг металл атомаар бүрэн солих эсвэл үндсэн молекул дахь гидроксо бүлгийг хүчиллэг үлдэгдэлээр бүрэн орлуулах бүтээгдэхүүн юм.
- Хүчиллэг давс- Хүчил дэх устөрөгчийн атомууд хэсэгчлэн металлын атомуудаар солигддог. Тэдгээрийг илүүдэл хүчил бүхий суурийг саармагжуулах замаар олж авдаг. Зөв нэрлэхийн тулд хүчил давс,хүчил давсыг бүрдүүлдэг устөрөгчийн атомын тооноос хамааран хэвийн давсны нэрэнд гидро- эсвэл дигидро- угтвар нэмэх шаардлагатай.Жишээ нь KHCO 3 нь калийн бикарбонат, KH 2 PO 4 нь калийн дигидроортофосфат юм. . Хүчиллэг давс нь зөвхөн хоёр ба түүнээс дээш үндсэн хүчил үүсгэж болно гэдгийг санах нь зүйтэй.
- Үндсэн давсууд- суурийн гидроксо бүлгүүд (OH -) хэсэгчлэн хүчиллэг үлдэгдэлээр солигдоно. Нэрлэх үндсэн давс,давсыг бүрдүүлдэг OH бүлгийн тооноос хамаарч ердийн давсны нэрэнд гидроксо- эсвэл дигидроксо- угтвар нэмэх шаардлагатай.Жишээ нь (CuOH) 2 CO 3 нь зэс (II) гидроксокарбонат юм. Үндсэн давс нь зөвхөн хоёр ба түүнээс дээш гидроксо бүлэг агуулсан суурь үүсгэж болно гэдгийг санах нь зүйтэй.
- давхар давс- Тэдний найрлагад хоёр өөр катион байдаг бөгөөд тэдгээрийг талсжуулах замаар олж авдаг холимог уусмалөөр өөр катионтой боловч ижил анионтой давс. Жишээлбэл, KAl(SO 4) 2, KNaSO 4.
- холимог давс- тэдгээрийн найрлагад хоёр өөр анион байдаг. Жишээлбэл, Ca(OCl)Cl.
- Гидрат давс (кристал гидрат) - тэдгээрт талсжих усны молекулууд орно. Жишээ нь: Na 2 SO 4 10H 2 O.

Органик бодисын ангилал
Зөвхөн устөрөгч ба нүүрстөрөгчийн атом агуулсан нэгдлүүдийг нэрлэдэг нүүрсустөрөгч. Энэ хэсгийг эхлэхээс өмнө бүртгэлийг хялбарчлахын тулд химич нар нүүрстөрөгч, устөрөгчийг гинжээр буддаггүй, харин нүүрстөрөгч нь дөрвөн холбоо үүсгэдэг гэдгийг бүү мартаарай, хэрэв зураг дээр нүүрстөрөгч нь хоёр бондоор холбогддог бол хоёр холбоогоор холбогддог. Сүүлийнх нь тодорхойгүй боловч устөрөгчтэй илүү их холбоо тогтоодог.

Нүүрстөрөгчийн гинжин хэлхээний бүтцээс хамааран органик нэгдлүүдийг нээлттэй гинж бүхий нэгдлүүдэд хуваадаг. цикл бус(алифатик) ба мөчлөгт- атомын хаалттай гинжин хэлхээтэй.
Циклхоёр бүлэгт хуваагддаг: карбоцикликхолболтууд ба гетероцикл.
Карбоциклик нэгдлүүд, эргээд хоёр цуврал нэгдлүүдийг багтаана: алицикликболон үнэрт.
үнэрт нэгдлүүдмолекулуудын бүтэц нь тусгай зориулалтын хавтгай нүүрстөрөгч агуулсан циклүүд дээр суурилдаг хаалттай системπ электронууд. нийтлэг π-систем (нэг π-электрон үүл) үүсгэх.

Ациклик (алифатик) ба циклик нүүрсустөрөгчийн аль аль нь олон (давхар эсвэл гурвалсан) холбоог агуулж болно. Эдгээр нүүрсустөрөгчийг нэрлэдэг хязгааргүй(ханаагүй), эсрэгээрээ ахиу(ханасан) зөвхөн нэг холбоог агуулсан.
Пи-бонд (π-бонд) - ковалент холбоо, p-атомын орбиталуудын давхцалаас үүссэн. s-атомын орбиталууд атомын бондын шугамын дагуу давхцах үед үүсдэг сигма холбооноос ялгаатай нь p-атомын орбиталууд атомын бондын шугамын хоёр талд давхцах үед пи бонд үүсдэг.
Ароматик систем, жишээлбэл, бензол C6H6 үүсэх тохиолдолд нүүрстөрөгчийн зургаан атом тус бүр нь sp2 - эрлийзжих төлөвт байгаа бөгөөд 120 ° өнцгөөр гурван сигма холбоо үүсгэдэг. Нүүрстөрөгчийн атом бүрийн дөрөв дэх p-электрон нь бензолын цагирагийн хавтгайд перпендикуляр байрладаг. Ерөнхийдөө бензиний цагирагийн бүх нүүрстөрөгчийн атомуудад нэг холбоо үүсдэг. Сигма бондын хавтгайн хоёр талд өндөр электрон нягтралтай pi бондын хоёр бүс үүсдэг. Ийм холболттой бол бензолын молекул дахь бүх нүүрстөрөгчийн атомууд эквивалент болж хувирдаг тул ийм систем нь гурван орон нутгийн давхар холбоо бүхий системээс илүү тогтвортой байдаг.

Хязгаарын алифат нүүрсустөрөгчийг алкан гэж нэрлэдэг бөгөөд тэдгээр нь C n H 2n + 2 ерөнхий томьёотой бөгөөд энд n нь нүүрстөрөгчийн атомын тоо юм. Тэдний хуучин нэрийг өнөөдөр ихэвчлэн ашигладаг - парафин:
Нэг гурвалсан холбоо бүхий ханаагүй алифат нүүрсустөрөгчийг алкин гэж нэрлэдэг. Тэдний ерөнхий томьёо C n H 2n - 2
Алициклик нүүрсустөрөгчийг хязгаарлах - циклоалканууд, тэдгээрийн ерөнхий томъёо нь C n H 2n:

Бид нүүрсустөрөгчийн ангиллыг авч үзсэн. Гэхдээ эдгээр молекулуудад нэг буюу хэд хэдэн устөрөгчийн атомыг бусад атомууд эсвэл атомын бүлгүүд (галоген, гидроксил бүлэг, амин бүлэг гэх мэт) сольж байвал нүүрсустөрөгчийн деривативууд үүсдэг: галоген деривативууд, хүчилтөрөгч агуулсан, азот агуулсан болон бусад органик бодисууд. нэгдлүүд.

Хамгийн ихийг тодорхойлдог атомууд эсвэл атомын бүлгүүд онцлог шинж чанарууд энэ ангибодисуудыг функциональ бүлгүүд гэж нэрлэдэг.
Ижил функциональ бүлэгтэй үүсмэл нүүрсустөрөгч нь гомолог цуврал үүсгэдэг.
Гомолог цуврал гэдэг нь ижил төрлийн (гомологууд) хамаарах нэгдлүүдийн цуврал бөгөөд найрлага нь бие биенээсээ -CH 2 - бүлгийн бүхэл тоогоор (гомологийн ялгаа) ялгаатай, ижил төстэй бүтэцтэй, тиймээс ижил төстэй химийн шинж чанартай байдаг.
ижил төстэй байдал химийн шинж чанаргомологууд нь органик нэгдлүүдийн судалгааг ихээхэн хялбаршуулдаг.
Орлуулсан нүүрсустөрөгч
- Нүүрс устөрөгчийн галоген деривативууднэг буюу хэд хэдэн устөрөгчийн атомын нүүрсустөрөгчийг галоген атомаар орлуулах бүтээгдэхүүн гэж үзэж болно. Үүний дагуу хязгаарлагдмал ба хязгааргүй моно-, ли-, три- (д ерөнхий тохиолдолполи-) галоген дериватив.Ханасан нүүрсустөрөгчийн галоген деривативын ерөнхий томьёо нь R-G.Хүчилтөрөгч агуулсан органик бодисуудад спирт, фенол, альдегид, кетон, карбоксилын хүчил, эфир, эфир орно.
- Архи- нэг буюу хэд хэдэн устөрөгчийн атомыг гидроксил бүлгээр сольсон нүүрсустөрөгчийн дериватив.Архи нь нэг гидроксил бүлэгтэй бол нэг атомт, алканы дериватив бол ханасан гэж нэрлэнэ.Ханасан нэг атомт спиртийн ерөнхий томъёо: R-OH.
- Фенолууд- Бензолын цагираг дахь нэг буюу хэд хэдэн устөрөгчийн атомыг гидроксил бүлгээр сольсон үнэрт нүүрсустөрөгчийн деривативууд (бензолын цуврал).
- Альдегид ба кетонууд- карбонилийн бүлэг атом (карбонил) агуулсан нүүрсустөрөгчийн деривативууд Альдегидийн молекулуудад нэг карбонилийн холбоо нь устөрөгчийн атомтай, нөгөө нь нүүрсустөрөгчийн радикалтай холбогддог.Кетоны хувьд карбонилийн бүлэг нь хоёр (ерөнхийдөө ялгаатай) радикалууд.
- Эфирхүчилтөрөгчийн атомаар холбогдсон нүүрсустөрөгчийн хоёр радикал агуулсан органик бодисууд: R=O-R эсвэл R-O-R 2. Радикалууд нь ижил эсвэл өөр байж болно. Эфирийн найрлагыг C n H 2n +2O томъёогоор илэрхийлнэ.
- Эфир- карбоксилын хүчил дэх карбоксил бүлгийн устөрөгчийн атомыг нүүрсустөрөгчийн радикалаар солих замаар үүссэн нэгдлүүд.
- Нитро нэгдлүүд- нэг буюу хэд хэдэн устөрөгчийн атомыг нитро бүлгээр сольсон нүүрсустөрөгчийн дериватив -NO 2 .
- Аминууд- устөрөгчийн атомыг нүүрсустөрөгчийн радикалаар сольсон аммиакийн деривативт тооцогдох нэгдлүүд.Радикалын шинж чанараас хамааран аминууд алифатик байж болно. Радикалаар солигдсон устөрөгчийн атомын тооноос хамааран анхдагч, хоёрдогч, гуравдагч аминуудыг ялгадаг. Тодорхой тохиолдолд хоёрдогч болон гуравдагч аминууд ижил радикалуудтай байж болно. Анхдагч аминуудыг мөн нэг устөрөгчийн атомыг амин бүлгээр сольдог нүүрсустөрөгчийн (алкан) дериватив гэж үзэж болно. Амин хүчлүүд нь нүүрсустөрөгчийн радикалтай холбогдсон хоёр функциональ бүлгийг агуулдаг - амин бүлэг -NH 2 ба карбоксил -COOH.
Бусад чухал органик нэгдлүүд нь хэд хэдэн ялгаатай буюу ижил функциональ бүлгүүд, бензолын цагирагтай холбоотой урт шугаман гинжтэй байдаг. Ийм тохиолдолд тухайн бодис нь тодорхой ангилалд хамаарах эсэхийг хатуу тодорхойлох боломжгүй юм. Эдгээр нэгдлүүдийг ихэвчлэн тодорхой бүлэг бодисуудад тусгаарладаг: нүүрс ус, уураг, нуклейн хүчил, антибиотик, алкалоид гэх мэт. Одоогийн байдлаар органик болон органик бус гэж ангилж болох олон нэгдлүүд бас мэдэгдэж байна. Тэдгээрийг органоэлементийн нэгдлүүд гэж нэрлэдэг. Тэдгээрийн заримыг нүүрсустөрөгчийн дериватив гэж үзэж болно.
Нэршил
Органик нэгдлүүдийг нэрлэхэд хоёр нэршил ашигладаг. оновчтой, системчилсэн (IUPAC) болон өчүүхэн нэрс.

IUPAC нэр томъёоны дагуу нэрсийн эмхэтгэл:
1) Нэгдлийн нэрний үндэс нь үндсэн хэлхээтэй ижил тооны атом бүхий ханасан нүүрсустөрөгчийг илэрхийлдэг үгийн үндэс юм.
2) Үндэс дээр ханалтын зэргийг тодорхойлсон дагавар залгана.
Ан (хязгаарлалттай, олон тооны бонд байхгүй);
Ён (давхар бонд байгаа тохиолдолд);
Ying (гурвалсан холболт байгаа тохиолдолд).

Хэрэв хэд хэдэн олон тооны холбоо байгаа бол ийм холболтын тоог (-диен, -триен гэх мэт) дагавар дээр, дагаварын дараа олон тооны холбоосын байрлалыг тоогоор зааж өгөх ёстой, жишээлбэл:
CH 3 -CH 2 -CH \u003d CH 2 CH 3 -CH \u003d CH -CH 3
бутен-1 бутен-2
CH 2 \u003d CH - CH \u003d CH 2
Гол гинжин хэлхээнд ороогүй нитро-, галоген, нүүрсустөрөгчийн радикалууд зэрэг бүлгүүдийг угтвар болгон авдаг. Тэдгээрийг цагаан толгойн үсгийн дарааллаар жагсаав. Орлуулагчийн байрлалыг угтварын өмнөх тоогоор заана.
Гарчгийн дараалал дараах байдалтай байна.
1. Хамгийн ихийг ол урт гинжатомууд C.
2. Гол хэлхээний нүүрстөрөгчийн атомуудыг мөчиртэй хамгийн ойрхон төгсгөлөөс эхлэн дараалан дугаарлана.
3. Алканы нэр нь хажуугийн радикалуудын нэрс, цагаан толгойн үсгийн дарааллаар жагсаасан, үндсэн хэлхээн дэх байрлал, үндсэн хэлхээний нэрээс бүрдэнэ.
 Нэрийн дараалал
Нэрийн дараалал Химийн хэл, энэ нь хамгийн өвөрмөц хэсгүүдийн нэг болох химийн бэлгэдлийг (үүнд болон химийн томъёо), хими сурах чухал идэвхтэй хэрэгсэл тул тодорхой бөгөөд ухамсартай хэрэглэхийг шаарддаг.
Химийн томъёо- эдгээр нь химийн тэмдэг, индекс болон бусад тэмдгүүдээр дамжуулан химийн бие даасан бодисын найрлага, бүтцийн нөхцөлт дүрс юм. Бодисын найрлага, химийн, электрон ба орон зайн бүтэц, тэдгээрийн физик, химийн шинж чанар, изомеризм болон бусад үзэгдлийг судлахдаа янз бүрийн төрлийн химийн томъёог ашигладаг.
Ялангуяа олон төрлийн томъёог (хамгийн энгийн, молекул, бүтцийн, проекц, конформацийн гэх мэт) бодисыг судлахад ашигладаг. молекулын бүтэц- ихэнх органик бодисууд ба органик бус бодисын харьцангуй бага хэсэг нь хэвийн нөхцөл. Маш их цөөн төрөлтомъёог (хамгийн энгийн нь) молекул бус нэгдлүүдийг судлахад ашигладаг бөгөөд тэдгээрийн бүтцийг бөмбөлөг хэлбэртэй загвар, болор бүтэц эсвэл тэдгээрийн нэгж эсийн диаграммуудаар илүү тодорхой тусгасан болно.

Нүүрс устөрөгчийн бүтцийн бүрэн ба товч томъёог гаргах
Жишээ:
Пропан C 3 H 8-ийн бүрэн бөгөөд товч бүтцийн томьёог гарга.
Шийдэл:
1. 3 нүүрстөрөгчийн атомыг нэг мөрөнд бичээд тэдгээрийг бондоор холбоно.
S–S–S
2. Нүүрстөрөгчийн атом бүрээс 4 холбоо үүсэхийн тулд зураас (бонд) нэмнэ үү.


4. Бүтцийн товч томъёог бичнэ үү.
CH 3 -CH 2 -CH 3
Уусах чадварын хүснэгт
Органик химийн хөгжлийн түүхэнд хоёр үеийг ялгадаг: эмпирик (17-р зууны дунд үеэс 18-р зууны эцэс хүртэл), органик бодисын талаархи мэдлэг, тэдгээрийг тусгаарлах, боловсруулах аргууд эмпирик байдлаар явагдсан. ба аналитик (18-р зууны төгсгөл - 19-р зууны дунд үе) нь органик бодисын найрлагыг тодорхойлох аргууд гарч ирсэнтэй холбоотой. Шинжилгээний явцад бүх органик бодисууд нүүрстөрөгч агуулдаг болохыг тогтоожээ. Органик нэгдлүүдийг бүрдүүлдэг бусад элементүүдээс устөрөгч, азот, хүхэр, хүчилтөрөгч, фосфор олдсон.
Органик химийн түүхэнд хамгийн чухал зүйл бол төрөлтөөр тэмдэглэгдсэн бүтцийн үе (19-р зууны хоёрдугаар хагас - 20-р зууны эхэн үе) юм. шинжлэх ухааны онолОрганик нэгдлүүдийн бүтэц, үүсгэн байгуулагч нь A.M. Бутлеров.
Органик нэгдлүүдийн бүтцийн онолын үндсэн заалтууд:
- молекул дахь атомууд нь тэдгээрийн валентийн дагуу химийн холбоогоор тодорхой дарааллаар холбогддог. Бүх органик нэгдлүүдийн нүүрстөрөгч нь дөрвөн валент;
- бодисын шинж чанар нь тэдгээрийн чанарын болон тоон найрлагаас гадна атомуудыг нэгтгэх дарааллаас хамаарна;
- Молекул дахь атомууд бие биедээ харилцан нөлөөлдөг.
Молекул дахь атомуудын холболтын дарааллыг химийн холбоог зураасаар дүрсэлсэн бүтцийн томъёогоор тодорхойлдог.
Органик бодисын онцлог шинж чанар
Бусад химийн нэгдлүүдээс ялгаатай нь органик нэгдлүүдийг тусад нь ялгах хэд хэдэн чухал шинж чанарууд байдаг.
- Органик нэгдлүүд нь ихэвчлэн хий, шингэн эсвэл хайлдаг хатуу бодис, нь ихэвчлэн хатуу байдаг органик бус нэгдлүүдээс ялгаатай өндөр температурхайлах.
- Органик нэгдлүүд нь ихэвчлэн ковалент байдлаар, органик бус нэгдлүүд нь ионоор үүсдэг.
- Органик нэгдлүүдийг (ялангуяа нүүрстөрөгчийн атомууд) үүсгэдэг атомуудын хооронд холбоо үүсэх янз бүрийн топологи нь изомерууд - ижил найрлагатай нэгдлүүдийг бий болгоход хүргэдэг. молекул жин, гэхдээ өөр физик, химийн шинж чанар. Энэ үзэгдлийг изомеризм гэж нэрлэдэг.
- Гомологийн үзэгдэл нь цувралын аль ч хоёр хөршийн томъёо (гомологууд) нь ижил бүлгээр ялгаатай байдаг органик нэгдлүүдийн цуврал оршихуй юм - CH 2 гомологийн ялгаа. органик бодисшатаж байна.
Органик бодисын ангилал
Ангилал нь хоёр чухал шинж чанарыг үндэс болгон авдаг - нүүрстөрөгчийн араг ясны бүтэц, молекул дахь функциональ бүлгүүд байгаа эсэх.
Органик бодисын молекулуудад нүүрстөрөгчийн атомууд бие биетэйгээ нэгдэж, гэгддэг бодисыг үүсгэдэг. нүүрстөрөгчийн араг яс эсвэл гинж. Гинж нь нээлттэй ба хаалттай (мөчлөгт), задгай гинж нь салбарлаагүй (хэвийн) ба салаалсан байж болно.
Нүүрстөрөгчийн араг ясны бүтцийн дагуу дараахь зүйлүүд байдаг.
- салаалсан болон салаагүй нээлттэй нүүрстөрөгчийн гинжин хэлхээтэй алициклик органик бодисууд. Жишээлбэл,
CH 3 -CH 2 -CH 2 -CH 3 (бутан)
CH 3 -CH (CH 3) -CH 3 (изобутан)
- нүүрстөрөгчийн гинж нь мөчлөгт (цагираг) хаалттай байдаг карбоциклик органик бодисууд. Жишээлбэл,

- циклд зөвхөн нүүрстөрөгчийн атомууд төдийгүй бусад элементүүдийн атомууд, ихэвчлэн азот, хүчилтөрөгч эсвэл хүхэр агуулсан гетероцикл органик нэгдлүүд:

Функциональ бүлэг нь нэгдэл нь тодорхой ангилалд хамаарах эсэхийг тодорхойлдог атом эсвэл нүүрсустөрөгчийн бус атомуудын бүлэг юм. Органик бодис нь нэг буюу өөр ангилалд хамаарах шинж тэмдэг нь функциональ бүлгийн шинж чанар юм (Хүснэгт 1).
Хүснэгт 1. Функциональ бүлгүүд ба ангиуд.

Нэгдлүүд нь нэгээс олон функциональ бүлгийг агуулж болно. Хэрэв эдгээр бүлгүүд ижил байвал нэгдлүүдийг полифункциональ гэж нэрлэдэг, жишээлбэл, хлороформ, глицерин. Төрөл бүрийн функциональ бүлгүүдийг агуулсан нэгдлүүдийг гетерофункциональ гэж нэрлэдэг бөгөөд тэдгээрийг нэгэн зэрэг хэд хэдэн төрлийн нэгдлүүдэд хамааруулж болно, жишээлбэл, сүүн хүчлийг карбоксилын хүчил ба спирт, коламиныг амин, спирт гэж үзэж болно.
Органик бодис нь нүүрстөрөгч агуулсан химийн нэгдэл юм. Зөвхөн үл хамаарах зүйл бол нүүрстөрөгчийн хүчил, карбид, карбонат, цианид, нүүрстөрөгчийн исэл юм.
Өгүүллэг
"Органик бодис" гэсэн нэр томъёо нь химийн шинжлэх ухааны хөгжлийн эхний үе шатанд эрдэмтдийн өдөр тутмын амьдралд гарч ирэв. Тэр үед виталист ертөнцийг үзэх үзэл давамгайлж байв. Энэ нь Аристотель, Плиний нарын уламжлалын үргэлжлэл байв. Энэ хугацаанд шинжээчид ертөнцийг амьд, амьгүй гэж хуваах завгүй байв. Үүний зэрэгцээ бүх бодисыг эрдэс ба органик гэж тодорхой хуваасан. "Амьд" бодисын нэгдлүүдийг нийлэгжүүлэхийн тулд тусгай "хүч" шаардлагатай гэж үздэг байв. Энэ нь бүх амьд биетэд байдаг бөгөөд үүнгүйгээр органик элементүүд үүсэх боломжгүй юм.
Энэ нь инээдтэй юм орчин үеийн шинжлэх ухаанЭнэхүү мэдэгдэл нь 1828 онд Фридрих Вёлер үүнийг туршилтаар няцаах хүртэл маш удаан хугацаанд ноёрхож байв. Тэрээр органик бус аммонийн цианатаас органик мочевин гаргаж авч чадсан. Энэ нь химийг урагшлуулсан. Гэсэн хэдий ч бодисыг органик ба органик бус гэж хуваах нь өнөөг хүртэл хадгалагдан үлджээ. Энэ нь ангиллын үндэс суурь болдог. Бараг 27 сая органик нэгдлүүдийг мэддэг.
Яагаад ийм олон органик нэгдлүүд байдаг вэ?
Органик бодис нь цөөн хэдэн үл хамаарах зүйл нь нүүрстөрөгчийн нэгдэл юм. Үнэндээ энэ бол маш сонирхолтой элемент юм. Нүүрстөрөгч нь атомаасаа гинж үүсгэх чадвартай. Тэдний хоорондын холболт тогтвортой байх нь маш чухал юм.
Үүнээс гадна органик бодис дахь нүүрстөрөгч нь валентыг харуулдаг - IV. Үүнээс үзэхэд энэ элемент нь бусад бодисуудтай дан ганц төдийгүй давхар, гурвалсан холбоо үүсгэх чадвартай байдаг. Тэдний олон талт байдал нэмэгдэхийн хэрээр атомын гинж богиносдог. Үүний зэрэгцээ холболтын тогтвортой байдал зөвхөн нэмэгддэг.
Мөн нүүрстөрөгч нь хавтгай, шугаман, гурван хэмжээст бүтэц үүсгэх чадвартай. Тийм ч учраас байгальд маш олон төрлийн органик бодисууд байдаг.
Нийлмэл

Дээр дурдсанчлан органик бодис нь нүүрстөрөгчийн нэгдлүүд юм. Мөн энэ нь маш чухал юм. Энэ нь үелэх системийн бараг бүх элементтэй холбоотой үед үүсдэг. Байгальд ихэнхдээ тэдгээрийн найрлагад (нүүрстөрөгчөөс гадна) хүчилтөрөгч, устөрөгч, хүхэр, азот, фосфор орно. Үлдсэн элементүүд нь илүү ховор байдаг.
Үл хөдлөх хөрөнгө
Тэгэхээр органик бодис бол нүүрстөрөгчийн нэгдэл юм. Үүний зэрэгцээ хэд хэдэн байдаг чухал шалгуурдагаж мөрдөх ёстой. Органик гаралтай бүх бодисууд нийтлэг шинж чанартай байдаг.
1. Атомуудын хооронд орших бондын янз бүрийн хэлбэр нь зайлшгүй изомер үүсэхэд хүргэдэг. Юуны өмнө тэдгээр нь нүүрстөрөгчийн молекулуудын нэгдлээс үүсдэг. Изомерууд нь янз бүрийн бодисуудижил молекул жинтэй, найрлагатай боловч өөр өөр химийн болон физик шинж чанартай. Энэ үзэгдлийг изомеризм гэж нэрлэдэг.
2. Өөр нэг шалгуур бол гомологийн үзэгдэл юм. Эдгээр нь органик нэгдлүүдийн цуврал бөгөөд хөрш зэргэлдээ бодисуудын томъёо нь өмнөхөөсөө нэг CH 2 бүлгээр ялгаатай байдаг. Энэхүү чухал шинж чанарыг материалын шинжлэх ухаанд ашигладаг.
Органик бодисыг ямар ангилдаг вэ?

Органик нэгдлүүдийн хэд хэдэн ангилал байдаг. Тэд бүгдэд мэдэгддэг. липид ба нүүрс ус. Эдгээр бүлгүүдийг биологийн полимер гэж нэрлэж болно. Тэд аливаа организмын эсийн түвшинд бодисын солилцоонд оролцдог. Мөн энэ бүлэгт нуклейн хүчлүүд орно. Тэгэхээр органик бодис бол бидний өдөр тутам идэж байгаа зүйл, бидний хийсэн зүйл гэж хэлж болно.
Хэрэм
Уургууд нь бүтцийн бүрэлдэхүүн хэсгүүдээс бүрддэг - амин хүчлүүд. Эдгээр нь тэдний мономерууд юм. Уургийг мөн уураг гэж нэрлэдэг. 200 орчим төрлийн амин хүчлийг мэддэг. Эдгээр нь бүгд амьд организмд байдаг. Гэхдээ тэдгээрийн ердөө хорь нь уургийн бүрэлдэхүүн хэсэг юм. Тэднийг үндсэн гэж нэрлэдэг. Гэхдээ бага алдартай нэр томъёог уран зохиолоос олж болно - протеиноген ба уураг үүсгэдэг амин хүчлүүд. Энэ ангийн органик бодисын томъёо нь амин (-NH 2) ба карбоксил (-COOH) бүрэлдэхүүн хэсгүүдийг агуулдаг. Тэд бие биетэйгээ ижил нүүрстөрөгчийн холбоогоор холбогддог.
Уургийн үүрэг

Ургамал, амьтны бие дэх уураг нь олон чухал үүргийг гүйцэтгэдэг. Гэхдээ хамгийн гол нь бүтцийн шинж чанартай байдаг. Уургууд нь эсийн мембраны үндсэн бүрэлдэхүүн хэсэг бөгөөд эс дэх органеллуудын матриц юм. Бидний биед артери, судас ба хялгасан судасны бүх хана, шөрмөс, мөгөөрс, хумс, үс нь голчлон янз бүрийн уурагуудаас бүрддэг.
Дараагийн функц нь ферментийн үйл ажиллагаа юм. Уургууд нь ферментийн үүрэг гүйцэтгэдэг. Тэд бие махбод дахь химийн урвалыг хурдасгадаг. Тэд хоол боловсруулах замд шим тэжээлийг задлах үүрэгтэй. Ургамал дахь ферментүүд фотосинтезийн үед нүүрстөрөгчийн байрлалыг тогтоодог.
Зарим нь хүчилтөрөгч гэх мэт янз бүрийн бодисыг биедээ авч явдаг. Органик бодис нь мөн тэдэнтэй нэгдэх боломжтой. Тээврийн функц ингэж ажилладаг. Уургууд нь металлын ион, өөх тосны хүчил, гормон, мэдээжийн хэрэг, нүүрстөрөгчийн давхар исэлба гемоглобин. Тээвэрлэлт мөн эс хоорондын түвшинд явагддаг.
Уургийн нэгдлүүд - иммуноглобулинууд нь хамгаалалтын функцийг хариуцдаг. Эдгээр нь цусны эсрэгбие юм. Жишээлбэл, тромбин ба фибриноген нь коагуляцийн үйл явцад идэвхтэй оролцдог. Тиймээс тэд их хэмжээний цус алдахаас сэргийлдэг.
Уургууд нь агшилтын үйл ажиллагааг хариуцдаг. Миозин ба актин протофибрил нь бие биенээсээ гулсах хөдөлгөөнийг байнга хийдэг тул булчингийн утаснууд агшиж байдаг. Гэхдээ ижил төстэй үйл явц нь нэг эсийн организмд тохиолддог. Бактерийн тугны хөдөлгөөн нь уургийн шинж чанартай бичил гуурсан хоолойн гулсахтай шууд холбоотой.
Органик бодис исэлдэхэд их хэмжээний энерги ялгардаг. Гэхдээ дүрмээр бол уураг нь эрчим хүчний хэрэгцээнд маш ховор хэрэглэгддэг. Энэ нь бүх нөөц дууссан үед тохиолддог. Липид ба нүүрс ус нь үүнд хамгийн тохиромжтой. Тиймээс уураг нь эрчим хүчний функцийг гүйцэтгэж чаддаг, гэхдээ зөвхөн тодорхой нөхцөлд л байдаг.
Липидүүд

Органик бодис нь мөн өөх тостой төстэй нэгдэл юм. Липидүүд нь хамгийн энгийн биологийн молекулуудад хамаардаг. Тэд усанд уусдаггүй боловч бензин, эфир, хлороформ зэрэг туйлшралгүй уусмалд задардаг. Эдгээр нь бүх амьд эсийн нэг хэсэг юм. Химийн хувьд липидүүд нь спирт ба карбоксилын хүчил юм. Тэдний хамгийн алдартай нь өөх тос юм. Амьтан, ургамлын биед эдгээр бодисууд олон чухал үүргийг гүйцэтгэдэг. Олон тооны липидийг анагаах ухаан, үйлдвэрлэлд ашигладаг.
Липидийн үйл ажиллагаа
Эдгээр органик химийн бодисууд нь эсийн уурагтай хамт үүсдэг биологийн мембранууд. Гэхдээ тэдний гол үүрэг бол эрчим хүч юм. Өөх тосны молекулууд исэлдэх үед асар их хэмжээний энерги ялгардаг. Энэ нь эсэд ATP үүсэхэд ордог. Липидийн хэлбэрээр их хэмжээний энергийн нөөц нь биед хуримтлагддаг. Заримдаа тэд ердийн амьдралыг хэрэгжүүлэхэд шаардагдахаас ч илүү байдаг. "Өөх" эсийн бодисын солилцооны эмгэг өөрчлөлтөөр энэ нь илүү их болдог. Хэдийгээр шударга ёсны үүднээс ийм хэт их нөөц нь амьтан, ургамлын өвөлжөөнд зайлшгүй шаардлагатай гэдгийг тэмдэглэх нь зүйтэй. Хүйтэн үед мод, бут сөөг нь хөрсөн дээр хооллодог гэж олон хүн үздэг. Бодит байдал дээр тэд зуны улиралд хийсэн тос, өөхний нөөцийг ашигладаг.
Хүн, амьтанд өөх тос нь хамгаалалтын функцийг гүйцэтгэдэг. Тэд арьсан доорх эд, бөөр, гэдэс зэрэг эрхтнүүдийн эргэн тойронд хуримтлагддаг. Тиймээс тэд сайн хамгаалалт болдог механик гэмтэл, өөрөөр хэлбэл, ажил хаялт.
Үүнээс гадна өөх тос нь дулаан дамжуулалт багатай байдаг тул дулааныг хадгалахад тусалдаг. Энэ нь ялангуяа хүйтэн цаг агаарт маш чухал юм. Далайн амьтдын арьсан доорх өөхний давхарга нь сайн хөвөх чадварыг бий болгодог. Гэхдээ шувуудын хувьд липидүүд нь ус зэвүүн, тослох үүргийг гүйцэтгэдэг. Лав нь тэдний өдийг бүрхэж, илүү уян хатан болгодог. Зарим төрлийн ургамал навчнууд дээр ижил товруутай байдаг.
Нүүрс ус

Органик бодисын томъёо C n (H 2 O) m нь нэгдэл нь нүүрс усны ангилалд багтдаг болохыг харуулж байна. Эдгээр молекулуудын нэр нь хүчилтөрөгч, устөрөгчийг устай ижил хэмжээгээр агуулдаг болохыг харуулж байна. Эдгээр химийн элементүүдээс гадна нэгдлүүд нь жишээлбэл, азот агуулсан байж болно.
Эсийн нүүрс ус нь органик нэгдлүүдийн үндсэн бүлэг юм. Эдгээр нь анхдагч бүтээгдэхүүн бөгөөд бусад бодисууд, тухайлбал, спирт, органик хүчил, амин хүчлүүд нь ургамлын нийлэгжилтийн анхны бүтээгдэхүүн юм. Нүүрс ус нь амьтан, мөөгөнцрийн эсийн нэг хэсэг юм. Тэд мөн бактери, эгэл биетний үндсэн бүрэлдэхүүн хэсгүүдийн дунд байдаг. Тиймээс амьтны эсэд тэд 1-ээс 2%, ургамлын эсэд тэдний тоо 90% хүрч болно.
Өнөөдрийг хүртэл зөвхөн гурван бүлэг нүүрс ус байдаг.
Энгийн сахар (моносахарид);
Дараалсан холбогдсон энгийн сахарын хэд хэдэн молекулуудаас бүрдэх олигосахаридууд;
Полисахаридууд нь 10 гаруй моносахарид ба тэдгээрийн деривативуудыг агуулдаг.
Нүүрс усны үүрэг

Эсийн бүх органик бодисууд үүрэг гүйцэтгэдэг тодорхой функцууд. Жишээлбэл, глюкоз нь эрчим хүчний гол эх үүсвэр юм. Энэ нь эсийн амьсгалын үед бүх эсэд задардаг. Гликоген ба цардуул нь гол энергийн нөөцийг бүрдүүлдэг бөгөөд эхнийх нь амьтанд, нөгөө нь ургамалд байдаг.
Нүүрс ус хийх ба бүтцийн функц. Целлюлоз нь ургамлын эсийн хананы гол бүрэлдэхүүн хэсэг юм. Мөн үе хөлт амьтдад хитин ижил үүрэг гүйцэтгэдэг. Энэ нь мөн дээд мөөгөнцрийн эсүүдэд байдаг. Хэрэв бид олигосахаридуудыг жишээ болгон авбал тэдгээр нь гликолипид ба гликопротейн хэлбэрээр цитоплазмын мембраны нэг хэсэг юм. Мөн гликокаликс нь ихэвчлэн эсүүдэд илэрдэг. Синтезд нуклейн хүчилпентозууд оролцдог. Хэзээ ДНХ-д, рибоз нь РНХ-д ордог. Мөн эдгээр бүрэлдэхүүн хэсгүүд нь коэнзим, жишээлбэл, FAD, NADP, NAD зэрэгт байдаг.
Нүүрс ус нь бие махбодид хамгаалалтын функцийг гүйцэтгэх чадвартай. Амьтанд гепарин бодис нь цусны өтгөрөлтөөс идэвхтэй сэргийлдэг. Энэ нь эдийг гэмтээх үед үүсдэг бөгөөд судаснуудад цусны бүлэгнэл үүсэхийг хориглодог. Гепарин орно олон тоогоормөхлөгт шигүү мөхлөгт эсүүдээс олддог.
Нуклейн хүчил

Уураг, нүүрс ус, липидүүд нь бүх төрлийн органик бодис биш юм. Химид мөн нуклейн хүчлүүд орно. Эдгээр нь фосфор агуулсан биополимерууд юм. Тэд бүх амьд оршнолуудын эсийн цөм, цитоплазмд байдаг тул генетикийн мэдээллийг дамжуулах, хадгалах боломжийг олгодог. Салмоны эр бэлгийн эсийг судалсан биохимич Ф.Мишерийн ачаар эдгээр бодисыг олж илрүүлсэн. Энэ бол "санамсаргүй" нээлт байв. Хэсэг хугацааны дараа РНХ, ДНХ нь бүх ургамал, амьтны организмаас олдсон. Нуклейн хүчлүүд нь мөөгөнцөр, бактери, түүнчлэн вирусын эсүүдээс тусгаарлагдсан байдаг.
Байгальд нийтдээ хоёр төрлийн нуклейн хүчлүүд олдсон - рибонуклеин (РНХ) ба дезоксирибонуклеин (ДНХ). Нэрнээс нь харахад ялгаа нь тодорхой. дезоксирибоз бол таван нүүрстөрөгчийн элсэн чихэр юм. Рибоз нь РНХ молекулд байдаг.
Органик хими бол нуклейн хүчлийг судалдаг шинжлэх ухаан юм. Судалгааны сэдвийг анагаах ухаан бас зааж өгдөг. Эрдэмтэд хараахан илрүүлээгүй байгаа ДНХ-ийн кодуудад олон генетикийн өвчин нуугдаж байна.
Эхний арга -нүүрсустөрөгчийн араг ясны шинж чанараар
I. Цикл буюу алифатикхолболтууд - гогцоо агуулаагүй:
хязгаар (ханасан, парафин)
давхар, гурвалсан холбоо бүхий ханаагүй (ханаагүй).
II. Карбоциклик(зөвхөн мөчлөгт нүүрстөрөгч) нэгдлүүд:
alicyclic - ханасан ба ханаагүй циклик нүүрсустөрөгч;
анхилуун үнэрт - тусгай үнэрт шинж чанартай коньюгат циклийн нэгдлүүд.
III. Гетероциклнэгдлүүд - гетероатомын мөчлөгийн нэг хэсэг болох (гетерос - бусад).
Хоёр дахь хандлага ньнэгдлийн химийн шинж чанарыг тодорхойлдог функциональ бүлгийн шинж чанараар.
|
Функциональ бүлэг |
Нэр |
||
|
нүүрсустөрөгч |
|||
|
Ацетилен |
|||
|
Галоген нэгдлүүд |
|||
|
Галоген деривативууд |
- Хал (галоген) |
Этил хлорид, этил хлорид |
|
|
Хүчилтөрөгчийн нэгдлүүд |
|||
|
Архи, фенол |
CH 3 CH 2 OH |
Этилийн спирт, этанол |
|
|
Эфир |
CH 3 -O-CH 3 |
диметил эфир |
|
|
Альдегид |
|
|
Цууны альдегид, этанал |
|
|
|
Ацетон, пропанон |
|
|
карбоксилын хүчил |
|
|
Цууны хүчил, этилийн хүчил |
|
Эфир |
|
|
Этил эфир Цууны хүчил, этил ацетат |
|
Галоген хүчил |
|
|
Цууны хүчил хлорид, ацетил хлорид |
|
Ангидрид |
|
|
Цууны ангидрид |
|
|
|
Цууны хүчил амид, ацетамид |
|
|
Азотын нэгдлүүд |
|||
|
Нитро нэгдлүүд |
Нитрометан |
||
|
этиламин |
|||
|
Ацетонитрил, цууны хүчлийн нитрил |
|||
|
Нитрозо нэгдлүүд |
Нитрособензол |
||
|
Усан нэгдлүүд |
Фенилгидразин |
||
|
Азо нэгдлүүд |
C 6 H 5 N=NC 6 H 5 |
Азобензол |
|
|
Диазоны давс |
Фенилдиазони хлорид |
||
Органик нэгдлүүдийн нэршил
1) 1892 (Женев, Олон улсын химийн конгресс) - Женева;
2) 1930 (Льеж, Олон улсын цэвэр ба хэрэглээний химийн холбоо (IUPAC) - Льеж;
Өчүүхэн нэршил : нэрсийг санамсаргүй байдлаар өгдөг.
Хлороформ, мочевин.
Модны сүнс, дарсны сүнс.
Шоргоолжны хүчил, сукцины хүчил.
Глюкоз, сахароз гэх мэт.
Рационал нэршил : "Ухаалаг холбоос" дээр үндэслэсэн - ангийн хамгийн энгийн төлөөлөгчийн нэр + ди-, три-, тетра-, пента- угтварыг ашиглан тоог харуулсан орлуулагчдын нэр (хамгийн энгийнээс эхлэн).
Энгийн органик нэгдлүүдийн хувьд, ялангуяа хуучин химийн уран зохиолд тохиолддог.

Орлуулагчдын байрлалыг латин үсгээр тэмдэглэв
эсвэл "тэгш хэмтэй" гэсэн үгс ( симм-), "тэгш бус" ( симм биш-), орто-(тухай-), мета- (м-), хос-(П-),
N- (азотын хувьд), O- (хүчилтөрөгчийн хувьд) үсэг.

IUPAC нэршил (олон улсын)
Энэхүү нэр томъёоны системийн үндсэн зарчмууд нь дараах байдалтай байна.
1. Суурь дээр - хамгийн дээд функциональ бүлэг бүхий хамгийн урт нүүрсустөрөгчийн гинж, дагавараар тэмдэглэгдсэн байдаг.
2. Гинжин дэх нүүрстөрөгчийн атомуудыг хамгийн дээд функциональ бүлэг нь ойр байх төгсгөлөөс нь дараалан дугаарлана.
Дугаарлахдаа давуу эрх (ceteris paribus) давхар, дараа нь гурвалсан холбоостой байна.
Хэрэв дугаарлах сонголт хоёулаа тэнцүү бол орлуулагчдын байрлалыг харуулсан цифрүүдийн нийлбэр нь хамгийн бага байхаар чиглэлийг сонгоно (илүү зөв, доод цифр нь эхнийх байх).
3. Орлуулагчдын нэрсийг нэрний үндсэн дээр нэмж, шаардлагатай бол ди-, три-, тетра-, пента- угтварыг ашиглан тэдний тоог зааж, хамгийн энгийнээс эхлэн нэмнэ.
Үүний зэрэгцээ, төлөө хүн бүрорлуулагч нь гинжин хэлхээнд түүний дугаарыг заана.
Орлуулагчдын байрлал, нэрийг гинжин хэлхээний нэрний өмнөх угтварт тэмдэглэж, тоог зураасаар тусгаарлана.
Функциональ бүлгүүдийн хувьд цифр нь гинжин нэрийн өмнө эсвэл гинжин нэрийн дараа, дагавар нэрийн өмнө эсвэл дараа нь зураасаар тусгаарлагдсан байж болно;
4. Орлуулагчдын нэрс (радикалууд) нь системчилсэн, өчүүхэн байж болно.
Алкил радикалуудыг төгсгөлийг өөрчилснөөр нэрлэнэ -enдээр - лагхаргалзах алканы нэрээр.
Радикалын нэр нь чөлөөт валенттай нүүрстөрөгчийн атомын төрлийг илэрхийлдэг: нүүрстөрөгчийн атомыг холбосон
нэг нүүрстөрөгчийн атомыг анхдагч -CH3 гэж нэрлэдэг.
хоёртой - хоёрдогч  ,
,
гурван - дээд зэрэглэлийн 
дөрөв - дөрөвдөгчтэй  .
.
Төгсгөлтэй эсвэл төгсгөлгүй бусад радикалууд - лаг, ихэвчлэн өчүүхэн нэртэй байдаг.
Хоёр валенттай радикалууд төгсгөлтэй байдаг -enэсвэл - таних.
|
Үндсэн холболт |
Нэр |
Радикал бүтэц |
Нэр |
|
Моновалент радикалууд |
|||
|
CH 3 -CH 2 - | |||
|
CH 3 -CH 2 -CH 3 |
CH 3 -CH 2 -CH 2 - | ||
|
|
изопропил ( хоёрдугаарт- пропил) |
||
|
CH 3 -CH 2 -CH 2 -CH 3 |
CH 3 -CH 2 -CH 2 -CH 2 - | ||
|
|
хоёрдугаарт-Бутил |
||
|
|
изобутан |
|
изобутил |
|
|
терт-Бутил |
||
|
CH 3 (CH 2) 3 CH 3 |
CH 3 (CH 2) 3 CH 2 – |
(n-амил) |
|
|
|
изопентан |
|
изопентил (изоамил) |
|
|
Неопентан |
|
Неопентил |
|
|
| ||
|
CH 2 \u003d CH–CH 2 - | |||
|
CH 3 -CH=CH- |
пропенил |
||
|
Шинжлэх ухаан бүр ойлголтоор ханасан байдаг, хэрэв эзэмшээгүй бол эдгээр ойлголтууд дээр суурилсан сэдвүүд эсвэл шууд бус сэдвүүд нь маш хэцүү байдаг. Өөрийгөө илүү их эсвэл бага боловсролтой гэж үздэг хүн бүрийн сайн ойлгох ёстой ойлголтуудын нэг бол материалыг органик болон органик бус гэж хуваах явдал юм. Хүн хэдэн настай байх нь хамаагүй, эдгээр ойлголтууд нь тодорхойлох ёстой хүмүүсийн жагсаалтад байдаг ерөнхий түвшинхүний амьдралын аль ч үе шатанд хөгжил. Эдгээр хоёр нэр томъёоны ялгааг ойлгохын тулд эхлээд тэдгээр нь юу болохыг олж мэдэх хэрэгтэй. Органик нэгдлүүд - энэ юу вэОрганик бодисууд нь гетероген бүтэцтэй химийн нэгдлүүдийн бүлэг бөгөөд үүнд орно нүүрстөрөгчийн элементүүдбие биентэйгээ ковалентаар холбогддог. Үл хамаарах зүйл нь карбид, нүүрстөрөгч, карбоксилын хүчил юм. Мөн нүүрстөрөгчөөс гадна бүрэлдэхүүн хэсгүүдийн нэг нь устөрөгч, хүчилтөрөгч, азот, хүхэр, фосфор, галоген зэрэг элементүүд юм. Ийм нэгдлүүд нь нүүрстөрөгчийн атомууд нэг, хоёр, гурвалсан холбоонд үлдэх чадвараас болж үүсдэг. Органик нэгдлүүдийн амьдрах орчин нь амьд биетүүд юм. Эдгээр нь амьд оршнолуудын найрлагад хоёуланд нь байж болох бөгөөд тэдний амин чухал үйл ажиллагааны (сүү, элсэн чихэр) үр дүнд гарч ирдэг. Органик бодисын синтезийн бүтээгдэхүүн нь хоол хүнс, эм, хувцас, барилгын материал, төрөл бүрийн тоног төхөөрөмж, тэсрэх бодис, янз бүрийн төрөл эрдэс бордоо, полимер, хүнсний нэмэлт, гоо сайхны бүтээгдэхүүн гэх мэт. Органик бус бодисууд - энэ юу вэОрганик бус бодисууд - нүүрстөрөгч, устөрөгч, химийн нэгдлүүдийг агуулаагүй химийн нэгдлүүдийн бүлэг бөгөөд түүний бүрэлдэхүүн хэсэг нь нүүрстөрөгч юм. Органик болон органик бус аль аль нь эсийн бүрэлдэхүүн хэсэг юм. Эхнийх нь амь өгөгч элемент хэлбэрээр, бусад нь усны найрлагаар, ашигт малтмалболон хүчил, түүнчлэн хий.
Органик болон органик бус бодисуудад ямар нийтлэг зүйл байдаг вэ?Антоним мэт санагдах хоёр ойлголтын хооронд юу нийтлэг байж болох вэ? Тэд бас нийтлэг зүйлтэй болох нь харагдаж байна, тухайлбал:
Органик болон органик бус бодисууд - Ялгаа нь юу вэ?
Үүнтэй төстэй нийтлэлүүд
2022 parki48.ru. Бид хүрээ байшин барьж байна. Тохижилт. Барилга. Суурь. | |||