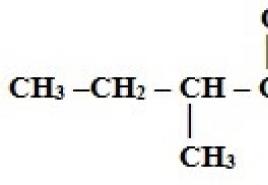Хімічні характеристики характерні для білків. «Білки. Одержання білків реакцією поліконденсації амінокислот. Первинна, вторинна та третинна структури білків. Хімічні властивості білків: горіння, денатурація, гідроліз та кольорові реакції. Біохімічні функції
Білки, або протеїни - складні, високомолекулярні органічні сполуки, Що складаються з амінокислот. Вони представляють головну, найважливішу частину всіх клітин та тканин тварин та рослинних організмів, без якої не можуть здійснюватися життєво важливі фізіологічні процеси. Білки неоднакові за своїм складом і властивостями у різних тварин і рослинних організмах і різних клітинах і тканинах одного й того ж організму. Білки різного молекулярного складу по-різному розчиняються в і у водних сольових розчинахв органічних розчинниках вони не розчиняються. Завдяки присутності в білковій молекулі кислих та основних груп вона має нейтральну реакцію.
Білки утворюють численні сполуки з будь-якими хімічними речовинами, що зумовлює їх особливе значенняв хімічних реакціях, що протікають в організмі та представляють основу всіх проявів життя та захисту її від шкідливих впливів Білки складають основу ферментів, антитіл, гемоглобіну, міоглобіну, багатьох гормонів, утворюють складні комплекси із вітамінами.
Вступаючи в сполуки з жирами та вуглеводами, білки можуть в організмі перетворюватися при своєму розщепленні на жири та вуглеводи. У тваринному організмі вони синтезуються лише з амінокислот та його комплексів – поліпептидів, а утворюватися з неорганічних сполук, жирів і вуглеводів вони можуть. Поза організмом синтезовано багато низькомолекулярних біологічно активних білкових речовин, подібних до тих, які є в організмі, наприклад деякі гормони.
Загальні відомості про білки та їх класифікацію
Білки - найважливіші біоорганічні сполуки, які з нуклеїновими кислотами займають особливу роль живому речовині - без цих сполук неможливе життя, оскільки, за визначенням Ф. Енгельса, життя є особливим існуванням білкових тіл тощо.
«Білки – це природні біополімери, які є продуктами реакції поліконденсації природних альфа-амінокислот».
Природних альфа-амінокислот 18-23 їх поєднання утворює нескінченно велику кількість різновидів молекул білків, що забезпечують різноманіття різних організмів. Навіть окремих особин організмів цього виду характерні свої власні білки, а ряд білків зустрічається у багатьох організмах.
Білки характеризуються наступним елементарним складом: вони утворені вуглецем, воднем, киснем, азотом, сіркою та деякими іншими хімічними елементами. Головною особливістю білкових молекул є обов'язкова наявність у них азоту (крім атомів С, Н, Про).
У молекулах білків реалізується «пептидна» зв'язок, тобто зв'язок між атомом С карбонільної групи та атомом азоту аміногрупи, яка зумовлює деякі особливості білкових молекул. У бічних ланцюгах молекули білка міститься велика кількість радикалів та функціональних груп, що «робить» молекулу білка поліфункціональною, здатною до значного різноманіття фізико-хімічних та біохімічних властивостей.
Через велику різноманітність білкових молекул і складність їх складу і властивостей, білки мають кілька різних класифікацій, заснованих на різних ознаках. Розглянемо деякі з них.
I. За складом розрізняють дві групи білків:
1. Протеїни (прості білки; молекула їх утворена лише білком, наприклад яєчний альбумін).
2. Протеїди - складні білки, молекули яких складаються з білкової та небілкової складових.
Протеїди поділяються на кілька груп, найважливішими з яких є:
1) глікопротеїди (складне з'єднання білка та вуглеводу);
2) ліпопротеїди (комплекс молекул білка та жирів (ліпідів);
3) нуклеопротеїди (комплекс білкових молекул та молекул нуклеїнових кислот).
ІІ. За формою молекули розрізняють дві групи білків:
1. Глобулярні білки - молекула білка має кулясту форму (форму глобули), наприклад молекули яєчного альбуміну; такі білки або розчиняються у воді, або здатні до утворення колоїдних розчинів.
2. Фібрилярні білки – молекули цих речовин мають форму ниток (фібрил), наприклад, міозин м'язів, фіброїн шовку. Фібрилярні білки нерозчинні у воді, вони утворюють структури, що реалізують скорочувальну, механічну, формоутворюючу та захисну функції, а також здатність організму пересуватися у просторі.
ІІІ. За розчинністю в різних розчинниках білки поділяють на кілька груп, з яких найбільш важливі такі:
1. Водорозчинні.
2. Жиророзчинні.
Існують інші класифікації білків.
Коротка характеристика природних альфа-амінокислот
Природні альфа-амінокислоти є різновидом амінокислот. Амінокислота - поліфункціональна органічна речовина, що містить у своєму складі як мінімум дві функціональні групи - аміногрупу (-NН 2) і карбоксильну (карбоксидну, останнє правильніше) групу (-СООН).
Альфа-амінокислоти - такі амінокислоти, в молекулах яких аміно-і карбоксильні групи знаходяться в одного атома вуглецю. Їхня загальна формула - NН 2 СН(R)СООН. Нижче наведено формули деяких природних альфа-амінокислот; вони записані у вигляді, зручному для написання рівнянь реакції поліконденсації та використовуються у разі, коли необхідно написати рівняння (схеми) реакцій отримання певних поліпептидів:
1) гліцин (амінооцтова кислота) - МН 2 СН 2 СООН;
2) аланін - NН 2 СН (СН 3) СООН;
3) фенілаланін - NН 2 СН (СН 2 С 6 Н 5) СООН;
4) серин - NН 2 СН (СН 2 ВІН) СООН;
5) аспарагінова кислота - NН 2 СН(СН 2 СООН)СООН;
6) цистеїн - NН 2 СН(СН 2 SН)СООН і т.д.
Деякі природні альфа-амінокислоти містять по дві аміногрупи (наприклад, лізин), дві карбоксидні групи (наприклад, аспарагінова і глутамінові кислоти), гідроксидні (ОН) групи (наприклад, тирозин), можуть бути циклічними (наприклад, пролін).
За характером впливу природних альфа-амінокислот на обмін речовин їх поділяють на замінні та незамінні. Незамінні амінокислоти повинні обов'язково надходити в організм із їжею.
Коротка характеристика структури молекул білка
Білки крім складного складу характеризуються складною будовою білкових молекул. Розрізняють чотири види структур білкових молекул.
1. Первинна структура характеризується порядком розташування залишків альфа-амінокислот у поліпептидному ланцюзі. Наприклад, тетрапептид (поліпептид, що утворився при поліконденсації чотирьох молекул амінокислоти) ала-фен-тіро-серин являє собою послідовність залишків аланіну, фенілаланіну, тирозину і серину, пов'язаних один з одним пептидним зв'язком.
2. Вторинна структура білкової молекули є просторовим розташуванням поліпептидного ланцюга. Воно буває різним, але найпоширенішою є альфа-спіраль, що характеризується певним «кроком» спіралі, розмірами та відстанню між окремими витками спіралі.
Стійкість вторинної структури білкової молекули забезпечується виникненням різноманітних хімічних зв'язків між окремими витками спіралі. Найважливіша роль серед них належить водневому зв'язку (реалізується за рахунок втягування ядра атома груп - NH 2 або NH в електронну оболонку атомів кисню або азоту), іонного зв'язку (реалізується за рахунок електростатичної взаємодії іонів -СОО - і - NH + 3 або = NH + 2) та інших видів зв'язку.
3. Третинна структура молекул білка характеризується просторовим розташуванням альфа-спіралі, чи іншої структури. Стійкість таких структур зумовлюється тими самими видами зв'язку, як і вторинна структура. В результаті реалізації третинної структури виникає «субодиниця» білкової молекули, що характерно для дуже складних молекул, а щодо простих молекул третинна структура є кінцевою.
4. Четвертична структура білкової молекули є просторове розташування субодиниць молекул білка. Вона характерна для складних білків, наприклад, гемоглобіну.
Розглядаючи питання структурі білкових молекул, необхідно розрізняти структуру живого білка - нативну структуру і структуру мертвого білка. Білок у живій речовині (нативний білок) відрізняється від білка, що зазнав впливу, при якому він може втратити властивості живого білка. Неглибоке вплив називають денатурацією, коли він надалі властивості живого білка можуть відновлюватися. Одним із видів денатурації є оборотна коагуляція. При незворотній коагуляції нативний білок перетворюється на «мертвий білок».
Коротка характеристика фізичних, фізико-хімічних та хімічних властивостей білка
Властивості білкових молекул мають велике значеннядля реалізації їх біолого-екологічних властивостей. Так, за агрегатним станом білки відносять до твердих речовин, які можуть бути розчинними або нерозчинними у воді чи інших розчинниках. Багато в біоекологічній ролі білків визначається фізичними властивостями. Так, здатність молекул білка утворювати колоїдні системи зумовлює їхню будівельну, каталітичну та інші функції. Нерозчинність білків у воді та інших розчинниках, їх фібрилярність обумовлює захисну та формоутворюючу функції тощо.
До фізико-хімічним властивостямбілків відноситься їх здатність до денатурації та коагуляції. Коагуляція проявляється у колоїдних системах, які є основою будь-якої живої речовини. При коагуляції частки укрупнюються за рахунок їхнього злипання. Коагуляція буває прихованою (її можна спостерігати лише під мікроскопом) та явною – її ознакою є випадання осаду білка. Коагуляція буває незворотною, коли після припинення дії коагулюючого фактора структура колоїдної системи не відновлюється, та оборотною, коли після видалення коагулюючого фактора колоїдна система відновлюється.
Прикладом оборотної коагуляції є випадання білка яєчного альбуміну під дією розчинів солей, причому осад білка розчиняється при розведенні розчину або при перенесенні осаду дистильовану воду.
Прикладом необоротної коагуляції є руйнування колоїдної структури білка альбуміну при нагріванні до кипіння води. При смерті (повній) жива речовина перетворюється на мертву за рахунок незворотної коагуляції всієї системи.
Хімічні властивостібілків дуже різноманітні через наявність у білкових молекулах великої кількості функціональних груп, а також за рахунок наявності пептидної та інших зв'язків у молекулах білка. З еколого-біологічних позицій найбільше значення має здатність молекул білка до гідролізу (при цьому зрештою виходить суміш природних альфа-амінокислот, які брали участь в утворенні даної молекули, в цій суміші можуть бути й інші речовини, якщо білок був протеїдом), до окислення (його продуктами можуть бути вуглекислий газ, вода, сполуки азоту, наприклад, сечовина, сполуки фосфору тощо).
Білки горять із виділенням запаху «паленого рогу» чи «паленого пір'я», що потрібно знати під час проведення екологічних дослідів. Відомі різні кольорові реакції на білок (біуретова, ксантопротеїнова та ін.), Докладніше про них - в курсі хімії.
коротка характеристикаеколого-біологічних функцій білків
Необхідно розрізняти еколого- біологічну рольбілків у клітинах та в організмі в цілому.
Еколого-біологічна роль білків у клітинах
Внаслідок того, що білки (поряд з нуклеїновими кислотами) - це речовини життя, їх функції в клітинах дуже різноманітні.
1. Найважливішою функцією білкових молекул є структурна функція, Що полягає в тому, що білок - це найважливіший компонент всіх структур, що утворюють клітину, до яких він входить до складу комплексу різних хімічних сполук.
2. Білок - найважливіший реагент у перебігу величезного різноманіття біохімічних реакцій, які забезпечують нормальне функціонуванняживої речовини, тому йому характерна реагентна функція.
3. У живій речовині реакції можливі лише у присутності біологічних каталізаторів - ферментів, а як встановлено в результаті біохімічних досліджень, мають білкову природу, тому виконують білки і каталітичну функцію.
4. У разі потреби у організмах білки окислюються і навіть виділяється , з допомогою якої синтезується АТФ, тобто. білки виконують і енергетичну функцію, але внаслідок того, що ці речовини мають для організмів особливу цінність (через їхній складний склад), то енергетична функція білків реалізується організмами тільки в критичних умовах.
5. Білки можуть виконувати і запасаючу функцію, оскільки є своєрідними «консервами» речовин та енергії для організмів (особливо рослин), що забезпечують їх початковий розвиток (для тварин – внутрішньоутробний, для рослин – розвиток зародків до появи молодого організму – проростка).
Ряд функцій білка характерні і клітин, і організму загалом, тому розглянуті нижче.
Еколого-біологічна роль білків в організмах (загалом)
1. Білки утворюють у клітинах і організмах особливі структури (у сукупності коїться з іншими речовинами), які здатні сприймати сигнали з довкілля як подразнень, рахунок чого виникає стан «збудження», яким організм відповідає певної реакцією, тобто. для білків і в клітині, і в організмі в цілому характерна функція, що сприймає.
2. Білкам характерна і провідна функція (і в клітинах, і в організмі в цілому), яка полягає в тому, що збудження, що виникло в певних структурах клітини (організму), передається у відповідний центр (клітини або організму), в якому формується певна реакція ( відповідь) організму або клітини на сигнал, що надійшов.
3. Багато організмів здатні до переміщення в просторі, що можливо за рахунок здатності структур клітини або організму до скорочення, а це можливо тому, що білки фібрилярної структури мають скорочувальну функцію.
4. Для гетеротрофних організмів білки як окремо, і у суміші коїться з іншими речовинами є продуктами харчування, т. е. їм характерна трофічна функція.
Коротка характеристика перетворень білків у гетеротрофних організмах на прикладі людини
Білки у складі їжі потрапляють у ротову порожнину, де змочуються слиною, подрібнюються зубами і перетворюються на гомогенну масу (при ретельному пережовуванні), і через глотку та стравохід надходять у шлунок (до попадання в останній з білками як сполуками нічого не відбувається).
У шлунку харчова грудка просочується шлунковим соком, що є секретом шлункових залоз. Шлунковий сік є водну систему, що містить хлороводень і ферменти, найважливішим з яких (для білків) є пепсин. Пепсин у кислому середовищі викликає процес гідролізу білків до пептонів. Харчова кашка далі надходить у перший відділ тонкого кишечника- дванадцятипалу кишку, в яку відкривається протока підшлункової залози, що виділяє панкреатичний сік, що володіє лужним середовищем і комплексом ферментів, з яких трипсин прискорює процес гідролізу білків і веде його до кінця, тобто до появи суміші природних альфа-амінокислот (вони розчин здатні всмоктуватись у кров ворсинками кишечника).
Ця суміш амінокислот надходить у міжтканинну рідину, а звідти - у клітини організму, в яких вони (амінокислоти) вступають у різні перетворення. Одна частина цих сполук безпосередньо використовується для синтезу білків, характерних для даного організму, друга - зазнає переамінування або дезамінування, даючи нові сполуки, необхідні організму, третя - окислюється і є джерелом енергії, необхідної організму для реалізації своїх життєвих функцій.
Необхідно відзначити деякі особливості внутрішньоклітинних перетворень білків. Якщо організм гетеротрофний і одноклітинний, то білки у складі їжі потрапляють усередину клітин у цитоплазму або спеціальні травні вакуолі, де під дією ферментів піддаються гідролізу, а далі все протікає так, як описано для амінокислот у клітинах. Клітинні структури постійно оновлюються, тому «старий» білок замінюється на «новий», причому перший гідролізується з отриманням суміші амінокислот.
У автотрофних організмів є свої особливості у перетвореннях білків. Первинні білки (у клітинах меристем) синтезуються з амінокислот, які синтезуються з продуктів перетворень первинних вуглеводів (вони виникли при фотосинтезі) та неорганічних азотовмісних речовин (нітратів або солей амонію). Заміна білкових структур у клітинах автотрофних організмів, що довго живуть, не відрізняється від такого для гетеротрофних організмів.
Азотна рівновага
Білки, які з амінокислот, - це основні сполуки, яким властиві процеси життя. Тому виключно важливим є облік обміну білків і продуктів їх розщеплення.
Азот у складі поту дуже мало, тому зазвичай аналіз поту на вміст азоту не робиться. Кількість азоту, що надійшов з їжею, і кількість азоту, що міститься в сечі та калі, множиться на 6,25 (16%) і з першої величини віднімається друга. У результаті визначається кількість азоту, що надійшов до організму та засвоєного ним.
Коли кількість азоту, що надійшла в організм з їжею, дорівнює кількості азоту в сечі і калі, т. е. що утворився при дезамінуванні, то є азотна рівновага. Азотиста рівновага властива, як правило, дорослому здоровому організму.
Коли кількість надійшов у організм азоту більше кількості виділеного азоту, є позитивний азотистий баланс, т. е. кількість білка, що у склад організму, більше кількості білка, що зазнав розпаду. Позитивний азотистий баланс характерний для здорового організму, що росте.
Коли надходження білка з їжею збільшується, то збільшується кількість азоту, що виділяється з сечею.
І, нарешті, коли кількість азоту, що надійшов в організм менше кількості виділеного азоту, то є негативний азотистий баланс, при якому розпад білка перевищує його синтез і руйнується білок, що входить до складу організму. Це буває при білковому голодуванні і тоді, коли не надходять необхідні організму амінокислоти. Негативний баланс азоту виявлений і після дії великих доз іонізуючого опромінення, що викликають посилений розпад білків в органах і тканинах.
Проблема білкового оптимуму
Мінімальна кількість білків їжі, необхідна для заповнення білків організму, що руйнуються, або величина розпаду білків організму при виключно вуглеводному харчуванні, позначається як коефіцієнт зношування. У дорослої людини найменша величина цього коефіцієнта близько 30 г білків на добу. Однак цієї кількості недостатньо.
Жири і вуглеводи впливають на витрату білків понад мінімум, необхідного для пластичних цілей, оскільки вони звільняють ту кількість енергії, яка була потрібна для розщеплення білків понад мінімум. Вуглеводи при нормальному харчуванні зменшують розщеплення білків у 3-3,5 разів більше, ніж при повному голодуванні.
Для дорослої людини при змішаній їжі, що містить достатню кількість вуглеводів та жирів, та масі тіла 70 кг норма білка на добу дорівнює 105 г.
Кількість білка, що повністю забезпечує зростання та життєдіяльність організму, позначається як білковий оптимум і дорівнює у людини при легкій роботі 100-125 г білка на добу, при тяжкій роботі – до 165 г, а при дуже тяжкій – 220-230 г.
Кількість білка на добу має бути по масі не менше 17% від загальної кількостіїжі, а з енергії - 14%.
Повноцінні та неповноцінні білки
Білки, які у організм з їжею, поділяються на біологічно повноцінні і біологічно неповноцінні.
Біологічно повноцінними називають ті білки, в яких у достатній кількості містяться всі амінокислоти, необхідні для синтезу білка тваринного організму. До складу повноцінних білків, необхідних для зростання організму, входять такі незамінні амінокислоти: лізин, триптофан, треонін, лейцин, ізолейцин, гістидин, аргінін, валін, метіонін, фенілаланін. З цих амінокислот можуть утворитися інші амінокислоти, гормони і т. д. З фенілаланіну утворюється тирозин, з тирозину шляхом перетворень – гормони тироксин та адреналін, з гістидину – гістамін. Метіонін бере участь в утворенні гормонів щитовидної залози і необхідний для утворення холіну, цистеїну та глютатіону. Він необхідний для окислювально-відновних процесів, азотистого обміну, засвоєння жирів, нормальної діяльності головного мозку. Лізин бере участь у кровотворенні, сприяє зростанню організму. Триптофан також необхідний для зростання, бере участь у освіті серотоніну, вітаміну РР, у тканинному синтезі. Лізин, цистин та валін збуджують серцеву діяльність. Малий вміст цистину в їжі затримує ріст волосся, підвищує вміст цукру в крові.
Біологічно неповноцінними називаються ті білки, в яких відсутні хоча б навіть одна амінокислота, яка не може бути синтезована тваринними організмами.
Біологічна цінність білка вимірюється кількістю білка організму, що утворюється із 100 г білка їжі.
Білки тваринного походження, що містяться в м'ясі, яйцях і молоці, найбільш полонені (70-95%). Білки рослинного походження мають меншу біологічну цінність, наприклад, білки житнього хліба, кукурудзи (60%), картоплі, дріжджів (67%).
Білок тваринного походження – желатину, в якому немає триптофану та тирозину, є неповноцінним. У пшениці та ячмені мало лізину, у кукурудзі мало лізину та триптофану.
Деякі амінокислоти замінюють один одного, наприклад, фенілаланін замінює тирозин.
Два неповноцінні білки, в яких бракує різних амінокислот, разом можуть скласти повноцінне білкове харчування.
Роль печінки у синтезі білків
У печінці синтезуються білки, що містяться в плазмі крові: альбуміни, глобуліни (за винятком гамма-глобулінів), фібриноген, нуклеїнові кислоти та численні ферменти, з яких деякі синтезуються тільки в печінці, наприклад, ферменти, що беруть участь у утворенні сечовини.
Білки, синтезовані в організмі, входять до складу органів, тканин і клітин, ферментів і гормонів (пластичні значення білків), але не запасаються організмом у вигляді різних білкових сполук. Тому та частина білків, яка не має пластичного значення, за участю ферментів дезамінується – розпадається зі звільненням енергії на різні азотисті продукти. Період напіврозпаду білків печінки дорівнює 10 дням.
Білкове харчування за різних умов
Нерозщеплений білок не може бути засвоєний організмом інакше, як через травний канал. Білок, введений поза травним каналом (парентерально), викликає захисну реакцію з боку організму.
Амінокислоти розщепленого білка та їх сполуки – поліпептиди – приносяться до клітин організму, у яких під впливом ферментів безперервно протягом усього життя відбувається синтез білків. Білки їжі мають переважно пластичне значення.
У період зростання організму – у дитячому та юнацькому віці – синтез білків особливо великий. У старості синтез білків зменшується. Отже, в процесі зростання відбувається ретенція, або затримка в організмі хімічних речовин, з яких складаються білки.
Вивчення обміну із застосуванням ізотопів показало, що в деяких органах протягом 2-3 діб приблизно половина всіх білків розпадається і така ж кількість білків заново синтезується організмом (ресинтез). У кожному організмі синтезуються специфічні білки, що відрізняються від білків інших тканин та інших організмів.
Подібно до жирів і вуглеводів, амінокислоти, не використані для побудови організму, піддаються розпаду зі звільненням енергії.
Амінокислоти, які утворюються з білків вмираючих клітин організму, що руйнуються, також піддаються перетворенням зі звільненням енергії.
У звичайних умовахкількість необхідного білка на добу для дорослої людини 1,5-2,0 г на 1 кг маси тіла, за умов тривалого холоду 3,0-3,5 г, за дуже важкої фізичної роботи 3,0-3,5 г.
Збільшення кількості білків більше, ніж до 3,0-3,5 г на 1 кг маси тіла, порушує діяльність. нервової системи, печінки та нирок.
Ліпіди, їх класифікація та фізіологічна роль
Ліпіди - речовини, нерозчинні у воді та розчиняються в органічних сполуках (спирті, хлороформі та ін.). До ліпідів відносяться нейтральні жири, жироподібні речовини (ліпоїди) та деякі вітаміни (A, D, E, K). Ліпіди мають пластичне значення та входять до складу всіх клітин та статевих гормонів.
Особливо багато ліпідів у клітинах нервової системи та надниркових залозах. Значна частина їх використовують організмом як енергетичний матеріал.
Фізичні властивості білків
1. У живих організмах білки перебувають у твердому та розчиненому стані. Багато білки є кристалами, проте, вони дають справжніх розчинів, т.к. молекула їх має дуже велику величину. Водні розчини білків - це гідрофільні колоїди, що знаходяться в протоплазмі клітин, і це активні білки. Кристалічні тверді білки – це запасні сполуки. Денатуровані білки (кератин волосся, міозин м'язів) є опорними білками.
2. Усі білки мають, як правило, велику молекулярну масу. Вона залежить від умов середовища (t°, рН) та методів виділення та коливається від десятків тисяч до мільйонів.
3. Оптичні характеристики. Розчини білка заломлюють світловий потік, і що більше концентрація білка, то сильніше заломлення. Користуючись цією властивістю можна визначити вміст білка в розчині. У вигляді сухих плівок білки поглинають інфрачервоні промені. Вони поглинаються пептидними групами. Денатурація білка - це внутрішньомолекулярне перегрупування його молекули, порушення нативної конформації, що не супроводжуються розщепленням пептидного зв'язку. Амінокислотна послідовність білка не змінюється. В результаті денатурації відбувається порушення вторинної, третинної та четвертинної структур білка, утворених нековалентними зв'язками, і біологічна активність білка втрачається повністю або частково, оборотно або незворотно залежно від агентів, що денатурують, інтенсивності та тривалості їх дії. Ізоелектрична точка Білки, як і амінокислоти, - амфотерні електроліти, які мігрують в електричному полі зі швидкістю, яка залежить від їх сумарного заряду та рН середовища. При певному кожному білка значенні рН його молекули електронейтральні. Це значення рН називається ізоелектричною точкою білка. Ізо-електрична точка білка залежить від числа та природи заряджених груп у молекулі. Білкова молекула заряджена позитивно, якщо рН середовища нижче величини її ізоелектричної точки, і негативно, якщо рН середовища вище значення ізоелектричної точки даного білка. У изоэлектрической точці білок має найменшу розчинність і найбільшу в'язкість, у результаті відбувається найлегше осадження білка з розчину – коагуляція білка. Ізоелектрична точка – одна з характерних констант білків. Однак якщо довести розчин білка до ізоелектричної точки, то сам по собі білок все ж таки не випадає в осад. Це гідрофільністю білкової молекули.
-
Фізичні властивості білків. 1. У живих організмах білкизнаходяться у твердому та розчиненому стані. Багато білкиє кристалами, однак... -
Фізично-хімічні властивості білківвизначаються їх високомолекулярною природою, компактність укладання поліпеп-тидних ланцюгів та взаємним розташуваннямзалишків амінокислот. -
Фізичні властивості білків 1. У живих організмах білкизнаходяться в твердому та рас. Класифікація білків. Усі природні білки(протеїни) поділяють на два великі класи... -
Речовини, що приєднуються до білкам (білки, вуглеводи, ліпіди, нуклеїнові кислоти), - ліганди. Фізико-хімічні властивості білків -
Первинна структура зберігається, але змінюються нативні властивості білката порушується функція. Чинники, що призводять до денатурації білків -
Фізичні властивості білків 1. У живих організмах білкиперебувають у твердому та розчиненому стані... докладніше». -
Фізично-хімічні властивості білківвизначаються їх високомолекулярною природою, компактністю.
Білки- Високомолекулярні органічні сполуки, що складаються із залишків α-амінокислот.
У склад білківвходять вуглець, водень, азот, кисень, сірка. Частина білків утворює комплекси з іншими молекулами, які містять фосфор, залізо, цинк та мідь.
Білки мають велику молекулярну масу: яєчний альбумін — 36 000, гемоглобін — 152 000, міозин — 500 000. Для порівняння: молекулярна маса спирту — 46, оцтової кислоти- 60, бензолу - 78.
Амінокислотний склад білків
Білки- Неперіодичні полімери, мономерами яких є α-амінокислоти. Зазвичай як мономери білків називають 20 видів α-амінокислот, хоча в клітинах і тканинах їх виявлено понад 170.
Залежно від того, чи можуть амінокислоти синтезуватися в організмі людини та інших тварин, розрізняють: замінні амінокислоти- Можуть синтезуватися; незамінні амінокислоти- Не можуть синтезуватися. Незамінні амінокислоти повинні надходити в організм разом із їжею. Рослини синтезують усі види амінокислот.
Залежно від амінокислотного складу, білки бувають: повноцінними- Містять весь набір амінокислот; неповноцінними- Якісь амінокислоти в їхньому складі відсутні. Якщо білки складаються лише з амінокислот, їх називають простими. Якщо білки містять окрім амінокислот ще й неамінокислотний компонент (простетичну групу), їх називають складними. Простетична група може бути представлена металами (металопротеїни), вуглеводами (глікопротеїни), ліпідами (ліпопротеїни), нуклеїновими кислотами (нуклеопротеїни).
Усе амінокислоти містять: 1) карбоксильну групу (-СООН); 2) аміногрупу (-NH 2); 3) радикал або R-групу (решта молекули). Будова радикала у різних видівамінокислот - різне. Залежно від кількості аміногруп та карбоксильних груп, що входять до складу амінокислот, розрізняють: нейтральні амінокислоти, Що мають одну карбоксильну групу та одну аміногрупу; основні амінокислоти, Що мають більше однієї аміногрупи; кислі амінокислоти, Що мають більше однієї карбоксильної групи
Амінокислоти є амфотерними сполуками, Так як у розчині вони можуть виступати як у ролі кислот, так і основ. У водних розчинах амінокислоти існують у різних іонних формах.
Пептидна зв'язок
Пептиди — органічні речовини, Що складаються із залишків амінокислот, з'єднаних пептидним зв'язком.
Утворення пептидів відбувається внаслідок реакції конденсації амінокислот. При взаємодії аміногрупи однієї амінокислоти з карбоксильною групою іншою між ними виникає ковалентний азот-вуглецевий зв'язок, яку і називають пептидний. Залежно кількості амінокислотних залишків, що входять до складу пептиду, розрізняють дипептиди, трипептиди, тетрапептидиі т.д. Утворення пептидного зв'язку може повторюватися багаторазово. Це призводить до освіти поліпептидів. На одному кінці пептиду знаходиться вільна аміногрупа (його називають N-кінцем), а на іншому - вільна карбоксильна група (його називають С-кінцем).

Просторова організація білкових молекул
Виконання білками певних специфічних функцій залежить від просторової конфігурації їх молекул, крім того, клітині енергетично невигідно тримати білки у розгорнутій формі, у вигляді ланцюжка, тому поліпептидні ланцюги піддаються укладання, набуваючи певної тривимірної структури, або конформації. Виділяють 4 рівні просторової організації білків.
Первинна структура білка- Послідовність розташування амінокислотних залишків у поліпептидному ланцюгу, що становить молекулу білка. Зв'язок між амінокислотами - пептидна.

Якщо молекула білка складається всього з 10 амінокислотних залишків, то теоретично можливих варіантів білкових молекул, що відрізняються порядком чергування амінокислот, — 10 20 . Маючи 20 амінокислот, можна скласти з них ще більшу кількість різноманітних комбінацій. В людини виявлено близько десяти тисяч різних білків, які відрізняються як один від одного, так і від білків інших організмів.
Саме первинна структура білкової молекули визначає властивості молекул білка та її просторову конфігурацію. Заміна лише однієї амінокислоти на іншу в поліпептидному ланцюжку призводить до зміни властивостей і функцій білка. Наприклад, заміна в β-субодиниці гемоглобіну шостої глутамінової амінокислоти на валін призводить до того, що молекула гемоглобіну в цілому не може виконувати свою основну функцію - транспорт кисню; у таких випадках у людини розвивається захворювання – серповидноклітинна анемія.
Вторинна структура- Упорядковане згортання поліпептидного ланцюга в спіраль (має вигляд розтягнутої пружини). Витки спіралі зміцнюються водневими зв'язками, що виникають між карбоксильними групами та аміногрупами. Практично всі СО- та NН-групи беруть участь в утворенні водневих зв'язків. Вони слабші пептидних, але, повторюючись багаторазово, надають цієї зміни стійкість і жорсткість. На рівні вторинної структури існують білки: фіброїн (шовк, павутиння), кератин (волосся, нігті), колаген (сухожилля).



Третинна структура- укладання поліпептидних ланцюгів у глобули, що виникає внаслідок виникнення хімічних зв'язків (водневих, іонних, дисульфідних) та встановлення гідрофобних взаємодій між радикалами амінокислотних залишків. Основну роль освіті третинної структури грають гидрофильно-гидрофобные взаємодії. У водних розчинах гідрофобні радикали прагнуть сховатися від води, групуючись усередині глобули, тоді як гідрофільні радикали в результаті гідратації (взаємодії з диполями води) прагнуть опинитися на поверхні молекули. У деяких білків третинна структура стабілізується дисульфідними ковалентними зв'язками, що виникають між атомами сірки двох залишків цистеїну. На рівні третинної структури є ферменти, антитіла, деякі гормони.

Четвертична структурай у складних білків, молекули яких утворені двома і більше глобулами. Субодиниці утримуються в молекулі завдяки іонним, гідрофобним та електростатичним взаємодіям. Іноді при утворенні четвертинної структури між субодиницями виникають дисульфідні зв'язки. Найбільш вивченим білком, що має четвертинну структуру, є гемоглобін. Він утворений двома α-субодиницями (141 амінокислотний залишок) і двома β-субодиницями (146 амінокислотних залишків). З кожною субодиницею пов'язана молекула гема, що містить залізо.
Якщо з будь-яких причин просторова конформація білків відхиляється від нормальної, білок не може виконувати своїх функцій. Наприклад, причиною «коров'ячого сказу» (губкоподібної енцефалопатії) є аномальна конформація пріонів – поверхневих білків нервових клітин.
Властивості білків
Амінокислотний склад, структура білкової молекули визначають його властивості. Білки поєднують у собі основні та кислотні властивості, що визначаються радикалами амінокислот: чим більше кислих амінокислот у білку, тим яскравіше виражені його кислотні властивості. Здатність віддавати та приєднувати Н+ визначають буферні властивості білків; один із найпотужніших буферів - гемоглобін в еритроцитах, що підтримує рН крові на постійному рівні. Є розчинні білки (фібриноген), є нерозчинні, що виконують механічні функції (фіброїн, кератин, колаген). Є білки активні у хімічному відношенні (ферменти), є хімічно неактивні, стійкі до дії різних умовдовкілля і вкрай нестійкі.
Зовнішні фактори (нагрівання, ультрафіолетове випромінювання, важкі метали та їх солі, зміни рН, радіація, зневоднення)
можуть спричиняти порушення структурної організації молекули білка. Процес втрати тривимірної конформації, властивої даної молекули білка, називають денатурацією. Причиною денатурації є розрив зв'язків, що стабілізують певну структуру білка. Спочатку рвуться найслабші зв'язки, а при посиленні умов і сильніші. Тому спочатку втрачається четвертинна, потім третинна та вторинна структури. Зміна просторової конфігурації призводить до зміни властивостей білка і, як наслідок, унеможливлює виконання білком властивих йому біологічних функцій. Якщо денатурація не супроводжується руйнуванням первинної структури, вона може бути оборотний, у разі відбувається самовідновлення властивої білку конформації. Такої денатурації зазнають, наприклад, рецепторні білки мембрани. Процес відновлення структури білка після денатурації називається ренатурацією. Якщо відновлення просторової конфігурації білка неможливе, то денатурація називається незворотній.
Функції білків
| Функція | Приклади та пояснення |
|---|---|
| Будівельна | Білки беруть участь в утворенні клітинних та позаклітинних структур: входять до складу клітинних мембран (ліпопротеїни, глікопротеїни), волосся (кератин), сухожиль (колаген) тощо. |
| Транспортна | Білок крові гемоглобін приєднує кисень і транспортує його від легень до всіх тканин та органів, а від них у легені переносить вуглекислий газ; До складу клітинних мембран входять особливі білки, які забезпечують активне і строго вибіркове перенесення деяких речовин та іонів з клітини у зовнішнє середовище і назад. |
| Регуляторна | Гормони білкової природи беруть участь у регулюванні процесів обміну речовин. Наприклад, гормон інсулін регулює рівень глюкози в крові, сприяє синтезу глікогену, збільшує утворення жирів із вуглеводів. |
| Захисна | У у відповідь проникнення в організм чужорідних білків чи мікроорганізмів (антигенів) утворюються особливі білки — антитіла, здатні пов'язувати і знешкоджувати їх. Фібрин, що утворюється з фібриногену, сприяє зупинці кровотеч. |
| Двигуна | Скорочувальні білки актин та міозин забезпечують скорочення м'язів у багатоклітинних тварин. |
| Сигнальна | У поверхневу мембрану клітини вбудовані молекули білків, здатних змінювати свою третинну структуру у відповідь на дію факторів зовнішнього середовища, таким чином здійснюючи прийом сигналів із зовнішнього середовища та передачу команд у клітину. |
| Запасаюча | В організмі тварин білки, як правило, не запасаються, виняток: альбумін яєць, казеїн молока. Але завдяки білкам в організмі можуть відкладатися про запас деякі речовини, наприклад, при розпаді гемоглобіну залізо не виводиться з організму, а зберігається, утворюючи комплекс з ферритином білком. |
| Енергетична | При розпаді 1 г білка до кінцевих продуктів виділяється 176 кДж. Спочатку білки розпадаються до амінокислот, а потім до кінцевих продуктів – води, вуглекислого газу та аміаку. Однак як джерело енергії білки використовуються тільки тоді, коли інші джерела (вуглеводи та жири) витрачені. |
| Каталітична | Одна з найважливіших функцій білків. Забезпечується білками - ферментами, які прискорюють біохімічні реакції, що відбуваються у клітинах. Наприклад, рибульозобіфосфаткарбоксилаза каталізує фіксацію 2 при фотосинтезі. |
Ферменти
Ферменти, або ензими, - Особливий клас білків, що є біологічними каталізаторами. Завдяки ферментам біохімічні реакції протікають із величезною швидкістю. Швидкість ферментативних реакцій у десятки тисяч разів (а іноді й у мільйони) вища за швидкість реакцій, що йдуть за участю неорганічних каталізаторів. Речовина, на яку надає свою дію фермент, називають субстратом.
Ферменти - глобулярні білки, особливостям будовиферменти можна розділити на дві групи: прості та складні. Прості ферментиє найпростішими білками, тобто. складаються лише з амінокислот. Складні ферментиє складними білками, тобто. до їх складу, крім білкової частини, входить група небілкової природи. кофактор. У деяких ферментів як кофактор виступають вітаміни. У молекулі ферменту виділяють особливу частину, яка називається активним центром. Активний центр- Невелика ділянка ферменту (від трьох до дванадцяти амінокислотних залишків), де і відбувається зв'язування субстрату або субстратів з утворенням фермент-субстратного комплексу. Після завершення реакції фермент-субстратний комплекс розпадається на фермент та продукт (продукти) реакції. Деякі ферменти мають (крім активного) алостеричні центри- Ділянки, до яких приєднуються регулятори швидкості роботи ферменту ( алостеричні ферменти).

Для реакцій ферментативного каталізухарактерні: 1) висока ефективність 2) строга вибірковість і спрямованість дії; 3) субстратна специфічність; 4) тонка та точна регуляція. Субстратну та реакційну специфічність реакцій ферментативного каталізу пояснюють гіпотези Е. Фішера (1890 р.) та Д. Кошланда (1959 р.).
Е. Фішер (гіпотеза «ключ-замок»)припустив, що просторові конфігурації активного центру ферменту та субстрату повинні точно відповідати один одному. Субстрат порівнюється з «ключом», фермент – із «замком».
Д. Кошланд (гіпотеза «рука-рукавичка»)припустив, що просторова відповідність структури субстрату та активного центру ферменту створюється лише в момент їхньої взаємодії один з одним. Цю гіпотезу ще називають гіпотезою індукованої відповідності.
Швидкість ферментативних реакцій залежить від: 1) температури; 2) концентрації ферменту; 3) концентрації субстрату; 4) рН. Слід наголосити, що оскільки ферменти є білками, то їх активність найбільш висока за фізіологічно нормальних умов.
Більшість ферментів може працювати лише за температури від 0 до 40 °С. У цих межах швидкість реакції підвищується приблизно 2 рази при підвищенні температури на кожні 10 °С. При температурі вище 40 ° С білок піддається денатурації та активність ферменту падає. При температурі, близькій до точки замерзання, ферменти інактивуються.
При збільшенні кількості субстрату швидкість ферментативної реакції зростає до тих пір, поки кількість молекул субстрату стане рівною кількості молекул ферменту. При подальшому збільшенні кількості субстрату швидкість не збільшуватиметься, оскільки відбувається насичення активних центрів ферменту. Збільшення концентрації ферменту призводить до посилення каталітичної активності, так як в одиницю часу перетворень піддається більша кількість молекул субстрату.

Для кожного ферменту існує оптимальне значеннярН, при якому він виявляє максимальну активність (пепсин – 2,0, амілаза слини – 6,8, ліпаза підшлункової залози – 9,0). При більш високих чи низьких значеннях рН активність ферменту знижується. При різких зрушеннях рН фермент денатурує.
Швидкість роботи алостеричних ферментів регулюється речовинами, що приєднуються до алостеричних центрів. Якщо ці речовини прискорюють реакцію, вони називаються активаторами, якщо гальмують інгібіторами.
Класифікація ферментів
За типом каталізованих хімічних перетворень ферменти поділені на 6 класів:
- оксиредуктази(перенесення атомів водню, кисню або електронів від однієї речовини до іншої - дегідрогеназу),
- трансферази(перенесення метильної, ацильної, фосфатної або аміногрупи від однієї речовини до іншої - трансаміназа),
- гідролази(Реакції гідролізу, при яких з субстрату утворюються два продукти - амілаза, ліпаза),
- ліази(негідролітичне приєднання до субстрату або відщеплення від нього групи атомів, при цьому можуть розриватися зв'язки С-С, С-N, С-О, С-S декарбоксилаза),
- ізомерази(Внутрішньомолекулярна перебудова - ізомераза),
- лігази(Сполука двох молекул в результаті утворення зв'язків С-С, С-N, С-О, С-S - синтетаза).
Класи у свою чергу поділені на підкласи та підпідкласи. У міжнародній класифікації, що діє, кожен фермент має певний шифр, що складається з чотирьох чисел, розділених точками. Перше число – клас, друге – підклас, третє – підпідклас, четверте – порядковий номерферменту в цьому підпідкласі, наприклад, шифр аргінази - 3.5.3.1.
Перейти до лекції №2«Будова та функції вуглеводів та ліпідів»
Перейти до лекції №4«Будова та функції нуклеїнових кислот АТФ»
5. Регуляторна функція. Білки здійснюють функції сигнальних речовин - деяких гормонів, гістогормонів та нейромедіаторів, є рецепторами до сигнальних речовин будь-якої будови, забезпечують подальшу передачу сигналу в біохімічних ланцюгах сигнальних клітини. Прикладами можуть бути гормон росту соматотропін, гормон інсулін, Н- і М-холінорецептори.
6. Двигуна функція. За допомогою білків здійснюються процеси скорочення та іншого біологічного руху. Прикладами можуть бути тубулін, актин, міозин.
7. Запасна функція. У рослинах містяться запасні білки, які є цінними харчовими речовинами, в організмах тварин м'язові білки є резервними поживними речовинами, які мобілізуються за крайньої необхідності.
Для білків характерним є кілька рівнів структурної організації.
Первинною структуроюбілка називають послідовність амінокислотних залишків поліпептидної ланцюга. Пептидна зв'язок - це карбоксамідна зв'язок між α-карбоксильною групою однієї амінокислоти та α-аміногрупою іншої амінокислоти.
аланілфенілаланілцистеілпролін
У п ептидного зв'язкує кілька особливостей:
а) вона резонансно стабілізована і тому перебуває практично в одній площині – планарна; обертання навколо зв'язку С-Nпотребує великих витрат енергії та утруднено;
б) у зв'язку -CO-NH- особливий характер, вона менша, ніж звичайна, але більше, ніж подвійна, тобто існує кетоенольна таутомерія:

в) заступники стосовно пептидного зв'язку перебувають у транс-положенні;
г) пептидний кістяк оточений різноманітними за своєю природою бічними ланцюгами, взаємодіючи з навколишніми молекулами розчинника, вільні карбоксильні та аміногрупи іонізуються, утворюючи катіонні та аніонні центри молекули білка. Залежно від їхнього співвідношення білкова молекула отримує сумарний позитивний чи негативний заряд, і навіть характеризується тим чи іншим значенням рН середовища при досягненні изоэлектрической точки білка. Радикали утворюють сольові, ефірні, дисульфідні містки всередині молекули білка, і навіть визначають коло реакцій, властивих білкам.
В даний часумовилися вважати білками полімери, що складаються зі 100 і більше амінокислотних залишків, поліпептидами - полімери, що складаються з 50-100 амінокислотних залишків, низькомолекулярними пептидами - полімери, що складаються з менш ніж 50 амінокислотних залишків.
Деякі низькомолекулярніпептиди відіграють самостійну біологічну роль. Приклади деяких пептидів:
Глутатіон - γ-глу-цис-глі - одинз найбільш поширених внутрішньоклітинних пептидів, бере участь в окислювально-відновних процесах в клітинах і переносі амінокислот через біологічні мембрани.
Карнозин - β-ала-гіс - пептид,що міститься у м'язах тварин, усуває продукти перекисного розщеплення ліпідів, прискорює процес розпаду вуглеводів у м'язах і у вигляді фосфату залучається до енергетичного обміну у м'язах.
Вазопресин - гормон задньої частки гіпофіза, що бере участь у регуляції водного обміну організму:

Фалоїдін- отруйний поліпептид мухомора, у нікчемних концентраціях спричиняє загибель організму внаслідок виходу ферментів та іонів калію з клітин:

Граміцидин - антибіотик, що діє на багато грампозитивних бактерій, змінює проникність біологічних мембран для низькомолекулярних сполук і викликає загибель клітин:

Міт-енкефалін - тир-глі-глі-фен-мет - пептид, що синтезується в нейронах і послаблює больові відчуття.
Вторинна структура білка- це просторова структура, що утворюється в результаті взаємодій між функціональними групами пептидного кістяка.
Пептидний ланцюг міститьбезліч СО-і NH-груп пептидних зв'язків, кожна з яких потенційно здатна брати участь в утворенні водневих зв'язків. Існують два головні типи структур, які дозволяють це здійснити: α-спіраль, в яку ланцюг згортається як шнур від телефонної трубки, і складчаста β-структура, в якій поруч укладені витягнуті ділянки одного або декількох ланцюгів. Обидві ці структури дуже стабільні.
α-Спіраль характеризуєтьсягранично щільною упаковкою скрученого поліпептидного ланцюга, на кожен виток правозакрученої спіралі припадає 3,6 амінокислотних залишків, радикали яких спрямовані завжди назовні і трохи назад, тобто на початок поліпептидного ланцюга.
Основні характеристики α-спіралі:
1) α-спіраль стабілізується водневими зв'язками між атомом водню при азоті пептидної групи та карбонільним киснем залишку, що віддаляється від даного вздовж ланцюга на чотири позиції;
2) в освіті водневого зв'язку беруть участь усі пептидні групи, це забезпечує максимальну стабільність α-спіралі;
3) в освіті водневих зв'язків залучені всі атоми азоту та кисню пептидних груп, що значною мірою знижує гідрофільність α-спіральних областей та збільшує їхню гідрофобність;
4) α-спіраль утворюється мимовільно і є найбільш стійкою конформацією поліпептидного ланцюга, що відповідає мінімуму вільної енергії;
5) у поліпептидному ланцюгу з L-амінокислот права спіраль, що зазвичай виявляється в білках, набагато стабільніше лівої.
Можливість утворення α-спіраліобумовлена первинною структурою білка. Деякі амінокислоти перешкоджають закручування пептидного кістяка. Наприклад, розташовані поруч карбоксильні групи глутамату та аспартату взаємно відштовхуються один від одного, що перешкоджає утворенню водневих зв'язків у α-спіралі. З цієї причини утруднена спіралізація ланцюга у місцях близько розташованих друг до друга позитивно заряджених залишків лізину і аргініну. Проте найбільшу роль порушення α-спіралі грає пролін. По-перше, в пролині атом азоту входить до складу жорсткого кільця, що перешкоджає обертанню навколо зв'язку N-C, по-друге, пролін не утворює водневий зв'язок через відсутність водню при атомі азоту.
β-складчастість - це шарувата структура, що утворюється водневими зв'язками між лінійно розташованими пептидними фрагментами Обидва ланцюги можуть бути незалежними або належати до однієї молекули поліпептиду. Якщо ланцюги орієнтовані одному напрямку, то така β-структура називається паралельної. У разі протилежного напрямку ланцюгів, тобто коли N-кінець одного ланцюга збігається з С-кінцем іншого ланцюга, β-структура називається антипаралельною. Енергетично краща антипаралельна β-складчастість з майже лінійними водневими містками.


паралельна β-складчастість антипаралельна β-складчастість
На відміну від α-спіралі, насиченою водневими зв'язками, кожна ділянка ланцюга β-складчастості відкрита для утворення додаткових водневих зв'язків. Бічні радикали амінокислот орієнтовані майже перпендикулярно до площини листа поперемінно вгору і вниз.
У тих ділянках, де пептидний ланцюгвигинається досить круто, часто знаходиться β-петля. Це короткий фрагмент, в якому 4 амінокислотні залишки згинаються на 180 про стабілізуються одним водневим містком між першим і четвертим залишками. Великі амінокислотні радикали заважають утворенню β-петлі, тому до неї найчастіше входить найменша амінокислота гліцин.
Надвторинна структура білка- це певний специфічний порядок чергування вторинних структур. Під доменом розуміють відокремлену частину молекули білка, що має певною мірою структурною та функціональною автономією. Зараз домени вважають фундаментальними елементами структури білкових молекул і співвідношення та характер компонування α-спіралей та β-шарів дає для розуміння еволюції білкових молекул та філогенетичних зв'язків більше, ніж зіставлення первинних структур.
Головним завданням еволюції єконструювання нових білків. Нескінченно малий шанс випадково синтезувати таку амінокислотну послідовність, яка б задовольнила умови упаковки та забезпечила виконання функціональних завдань. Тому часто зустрічаються білки з різною функцією, але подібні структурою настільки, що здається, що вони мали одного спільного предка або сталися один від одного. Схоже, що еволюція, зіткнувшись із необхідністю вирішити певне завдання, воліє не конструювати для цього білки спочатку, а пристосувати для цього вже добре налагоджені структури, адаптуючи їх для нових цілей.
Деякі приклади надвторинних структур, що часто повторюються:
1) αα - білки, що містять тільки α-спіралі (міоглобін, гемоглобін);
2) ββ - білки, що містять тільки β-структури (імуноглобуліни, супероксиддисмутаза);
3) βαβ' - структура β-барильця, кожен β-шар розташований усередині бочонки і пов'язаний з α-спіраллю, що знаходиться на поверхні молекули (тріозофосфоізомераза, лактатдегідрогеназа);
4) «цинковий палець» - фрагмент білка, що складається з 20 амінокислотних залишків, атом цинку пов'язаний з двома залишками цистеїну і двома гістидину, в результаті чого утворюється «палець» приблизно з 12 амінокислотних залишків, може зв'язуватися з регуляторними ділянками молекули ДНК;
5) «лейцинова застібка-блискавка» - білки, що взаємодіють, мають α-спіральну ділянку, що містить принаймні 4 залишки лейцину, вони розташовані через 6 амінокислот один від одного, тобто знаходяться на поверхні кожного другого витка і можуть утворювати гідрофобні зв'язки з лейциновими залишками іншого білка. За допомогою лейцинових застібок, наприклад, молекули сильноосновних білків гістонів можуть поєднуватися в комплекси, долаючи позитивний заряд.
Третинна структура білка- Це просторове розташування молекули білка, що стабілізується зв'язками між бічними радикалами амінокислот.
Типи зв'язків, що стабілізують третинну структуру білка:

електростатична воднева гідрофобна дисульфідна взаємодія зв'язку взаємодії зв'язку
Залежно від складаннятретинної структури білки можна класифікувати на два основні типи - фібрилярні та глобулярні.
Фібрилярні білки- нерозчинні у воді довгі ниткоподібні молекули, поліпептидні ланцюги яких витягнуті вздовж однієї осі. В основному це структурні та скорочувальні білки. Декілька прикладів найпоширеніших фібрилярних білків:
1. α-Кератини. Синтезуються клітинами епідермісу. На їхню частку припадає майже вся суха вага волосся, вовни, пір'я, рогів, нігтів, пазурів, голок, луски, копит і черепашого панцира, а також значна частина ваги зовнішнього шару шкіри. Це ціле сімейство білків, вони подібні до амінокислотного складу, містять багато залишків цистеїну і мають однакове просторове розташування поліпептидних ланцюгів.
У клітинах волосся поліпептидні ланцюги кератинуспочатку організуються в волокна, з яких формуються структури на кшталт каната або скрученого кабелю, що заповнює зрештою весь простір клітини. Клітини волосся стають при цьому сплощеним і, нарешті, відмирають, а клітинні стінки утворюють навколо кожного волосся трубчастий чохол, званий кутикулою. В α-кератині поліпептидні ланцюги мають форму α-спіралі, скручені одна довкола іншої в трижильний кабель з утворенням поперечних дисульфідних зв'язків.
N-кінцеві залишки розташованіз одного боку (паралельні). Кератини нерозчинні у воді через переважання в їхньому складі амінокислот з неполярними бічними радикалами, які спрямовані у бік водної фази. При хімічній завивці відбуваються такі процеси: спочатку шляхом відновлення тіолами руйнуються дисульфідні містки, а потім при наданні волоссю необхідної форми їх висушують нагріванням, при цьому за рахунок окислення киснем повітря утворюються нові дисульфідні містки, які зберігають форму зачіски.
2. β-кератини. До них відносяться фіброїн шовку та павутиння. Представляют собою антипаралельні β-складчасті шари з переважанням гліцину, аланіну та серину у складі.
3. Колаген. Найпоширеніший білок у вищих тварин та головний фібрилярний білоксполучних тканин. Колаген синтезується у фібробластах та хондроцитах - спеціалізованих клітинах сполучної тканини, з яких потім виштовхується. Колагенові волокна знаходяться у шкірі, сухожиллях, хрящах та кістках. Вони не розтягуються, за міцністю перевершують сталевий дріт, колагенові фібрили характеризуються поперечною смугастістю.
При кип'ятінні у воді волокнистий, нерозчинний і неперетравлюваний колаген перетворюється на желатин в результаті гідролізу деяких ковалентних зв'язків Колаген містить 35% гліцину, 11% аланіну, 21% проліну та 4-гідроксипроліну (амінокислоти, властивої тільки для колагену та еластину). Такий склад визначає відносно низьку поживну цінністьжелатину як харчового білка. Фібрили колагену складаються з поліпептидних субодиниць, що повторюються, званих тропоколагеном. Ці субодиниці укладені вздовж фібрили як паралельних пучків на кшталт «голова до хвоста». Зрушеність головок і надає характерної поперечної смугастість. Порожнечі в цій структурі при необхідності можуть бути місцем відкладення кристалів гідроксиапатиту Са 5 (ОН)(РО 4) 3 , що грає важливу рольу мінералізації кісток.


Тропоколагенові субодиниці складаютьсяіз трьох поліпептидних ланцюгів, щільно скручених у вигляді трижильного каната, що відрізняється від α- та β-кератинів. В одних колагенах усі три ланцюги мають однакову амінокислотну послідовність, тоді як в інших ідентичні лише два ланцюги, а третій відрізняється від них. Поліпептидний ланцюг тропоколагену утворює ліву спіраль, на один виток якої припадає лише три амінокислотні залишки через вигин ланцюга, обумовлений проліном і гідроксипроліном. Три ланцюги пов'язані між собою крім водневих зв'язків зв'язком ковалентного типу, що утворюється між двома залишками лізину, що знаходяться в сусідніх ланцюгах:

У міру того як ми стаємо старшими, в тропоколагенових субодиницях і між ними утворюється все більше поперечних зв'язків, що робить фібрили колагену більш жорсткими і крихкими, і це змінює механічні властивості хрящів і сухожиль, робить більш ламкими кістки і знижує прозорість рогівки ока.
4. Еластін. Міститься у жовтій еластичній тканині зв'язок та еластичному шарі сполучної тканини у стінках великих артерій. Основна субодиниця фібрил еластину - тропоеластин. Еластин багатий на гліцин і аланін, містить багато лізину і мало проліну. Спіральні ділянки еластину розтягуються при натягу, але повертаються при знятті навантаження до вихідної довжини. Залишки лізину чотирьох різних ланцюгів утворюють ковалентні зв'язки між собою та дозволяють еластину оборотно розтягуватися у всіх напрямках.
Глобулярні білки- білки, поліпептидний ланцюг яких згорнутий в компактну глобулу, здатні виконувати найрізноманітніші функції.
Третичну структуру глобулярних білківНайзручніше розглянути на прикладі міоглобіну. Міоглобін - це відносно невеликий кисень-зв'язуючий білок, який є присутнім у м'язових клітинах. Він запасає зв'язаний кисень і сприяє його перенесенню в мітохондрії. У молекулі міоглобіну знаходиться один поліпептидний ланцюг та одна гемогрупа (гем) - комплекс протопорфірину із залізом.
Основні властивості міоглобіну:
а) молекула міоглобіну настільки компактна, що в ній може вміститися всього 4 молекули води;
б) всі полярні амінокислотні залишки, за винятком двох, розташовані на зовнішній поверхні молекули, причому всі вони знаходяться у гідратованому стані;
в) більша частина гідрофобних амінокислотних залишків розташована всередині молекули міоглобіну і, таким чином, захищена від зіткнення з водою;
г) кожен із чотирьох залишків проліну в молекулі міоглобіну знаходиться в місці вигину поліпептидного ланцюга, в інших місцях вигину розташовані залишки серину, треоніну та аспарагіну, оскільки такі амінокислоти перешкоджають утворенню α-спіралі, якщо знаходяться один з одним;
д) плоска гемогрупа лежить у порожнині (кишені) поблизу поверхні молекули, атом заліза має два координаційні зв'язки, спрямовані перпендикулярно до площини гема, одна з них пов'язана з залишком гістидину 93, а інша служить для зв'язування молекули кисню.
Починаючи з третинної структури білокстає здатним виконувати властиві йому біологічні функції. У основі функціонування білків лежить те, що з укладанні третинної структури лежить на поверхні білка утворюються ділянки, які можуть приєднувати себе інші молекули, звані лигандами. Висока специфічність взаємодії білка з лігандом забезпечується комплементарністю структури активного центру структури ліганду. Комплементарність - це просторова та хімічна відповідність взаємодіючих поверхонь. Для більшості білків третинна структура - максимальний рівень укладання.
Четвертична структура білка- характерна для білків, що складаються з двох і більше поліпептидних ланцюгів, пов'язаних між собою виключно нековалентними зв'язками, переважно електростатичними та водневими. Найчастіше білки містять дві або чотири субодиниці, більше чотирьох субодиниць зазвичай містять регуляторні білки.
Білки, що мають четвертинну структуру, часто називаються олігомерними. Розрізняють гомомірні та гетеромерні білки. До гомомірних відносяться білки, у яких всі субодиниці мають однакову будову, наприклад, фермент каталаза складається з чотирьох абсолютно однакових субодиниць. Гетеромірні білки мають різні субодиниці, наприклад, фермент РНК-полімераза складається з п'яти різних за будовою субодиниць, що виконують різні функції.
Взаємодія однієї субодиницізі специфічним лігандом викликає конформаційні зміни всього олігомерного білка і змінює спорідненість інших субодиниць до лігандів, ця властивість є основою здатності олігомерних білків до алостеричної регуляції.
Четвертинну структуру білка можна розглянутиь на прикладі гемоглобіну. Містить чотири поліпептидні ланцюги та чотири простетичні групи гему, в яких атоми заліза знаходяться в закисній формі Fe 2+ . Білкова частина молекули – глобін – складається з двох α-ланцюгів та двох β-ланцюгів, що містять до 70% α-спіралей. Кожен із чотирьох ланцюгів має характерну для неї третинну структуру, з кожним ланцюгом пов'язана одна гемогрупа. Геми різних кіл порівняно далеко розташовані один від одного і мають різний кут нахилу. Між двома α-ланцюгами та двома β-ланцюгами утворюється мало прямих контактів, тоді як між α- і β-ланцюгами виникають численні контакти типу α 1 β 1 і α 2 β 2 , утворені гідрофобними радикалами. Між α 1 β 1 і α 2 β 2 залишається канал.
На відміну від міоглобінугемоглобін характеризуєтьсязначно нижчою спорідненістю до кисню, що дозволяє йому при низьких парціальних тисках кисню, що існують у тканинах, віддавати їм значну частину пов'язаного кисню. Кисень легше зв'язується залізом гемоглобіну при більш високих значеннях рН і низької концентрації 2 , властиві альвеол легень; звільненню кисню з гемоглобіну сприяють нижчі значення рН і високі концентрації СО 2 властиві тканинам.
Крім кисню гемоглобін переносить іони водню, які зв'язуються із залишками гістидину в ланцюгах. Також гемоглобін переносить вуглекислий газ, який приєднує до кінцевої аміногрупи кожної з чотирьох поліпептидних ланцюгів, у результаті чого утворюється карбаміногемоглобін:

Уеритроцитах у досить великих концентраціяхприсутня речовина 2,3-дифосфогліцерат (ДФГ), його вміст збільшується при підйомі на велику висоту та при гіпоксії, полегшуючи вивільнення кисню з гемоглобіну в тканинах. ДФГ розташовується в каналі між α 1 β 1 і α 2 β 2 , взаємодіючи з позитивно зараженими групами β-ланцюгів. При зв'язуванні гемоглобіном кисню ДФГ витісняється із порожнини. В еритроцитах деяких птахів міститься не ДФГ, а инозитолгекса-фосфат, який ще більше знижує спорідненість з гемоглобіном до кисню.
 2,3-дифосфогліцерат (ДФГ)
2,3-дифосфогліцерат (ДФГ)
HbA - нормальний гемоглобін дорослої людини, HbF - фетальний гемоглобін, має більшу спорідненість до О 2 , HbS - гемоглобін при серповидноклітинній анемії. Серповидноклітинна анемія – це серйозне спадкове захворювання, пов'язане з генетичною аномалією гемоглобіну. У крові хворих людей спостерігається надзвичайно велика кількість тонких серповидних еритроцитів, які, по-перше, легко розриваються, по-друге, закупорюють кровоносні капіляри.
На молекулярному рівні гемоглобін S відрізняєтьсявід гемоглобіну А по одному амінокислотному залишку в положенні 6 -ланцюгів, де замість залишку глутамінової кислоти знаходиться валін. Таким чином, гемоглобін S містить на два негативні заряди менше, поява валіну призводить до виникнення «липкого» гідрофобного контакту на поверхні молекули, в результаті при дезоксигенації молекули дезоксигемоглобіну S злипаються і утворюють нерозчинні аномально довгі ниткоподібні агрегати, що призводять до деформації еритроцитів.
Немає жодних підстав думати, що існує незалежний генетичний контроль за формуванням рівнів структурної організації білка вище за первинний, оскільки первинна структура визначає і вторинну, і третинну, і четвертинну (якщо вона є). Нативною конформацією білка є термодинамічно найбільш стійка в умовах структура.
ЛЕКЦІЯ 6
Розрізняють фізичні, хімічні та біологічні властивості білків.
Фізичними властивостями білківє наявність молекулярної маси, подвійне променезаломлення (зміна оптичної характеристики розчину білка, що знаходиться в русі, в порівнянні з розчином, що перебуває в спокої), обумовлене несферичною формою білків, рухливість в електричному полі, обумовлена зарядом молекул білка. Крім цього для білків характерні оптичні властивості, що полягають у здатності обертати площину поляризації світла, розсіювати світлові промені через значні розміри білкових частинок і поглинати ультрафіолетові промені.
Однією з характерних фізичних властивостейбілками є здатність адсорбувати на поверхні, а іноді й захоплювати всередину молекули, низькомолекулярні органічні сполуки та іони.
Хімічні властивості білків відрізняютьсявинятковою різноманітністю, так як для білків характерні всі реакції амінокислотних радикалів і характерна реакція гідролізу пептидних зв'язків.
Маючи значну кількість кислотних та основних груп, білки виявляють амфотерні властивості На відміну від вільних амінокислот кислотно-основні властивості білків обумовлені не α-аміно- та α-карбокси-групами, зайнятими в утворенні пептидних зв'язків, а зарядженими радикалами амінокислотних залишків. Основні властивості білків обумовлені залишками аргініну, лізину та гістидину. Кислі властивості обумовлені залишками аспарагінової та глутамінової кислоти.
Криві титрування білків достатньоскладні для інтерпретації, тому що в будь-якому білку є занадто велике числотитрованих груп, між іонізованими групами білка є електростатичні взаємодії, на рК кожної групи, що титрується, впливають поруч розташовані гідрофобні залишки і водневі зв'язки. Найбільше практичне застосування має изоэлектрическая точка білка - значення рН, у якому сумарний заряд білка дорівнює нулю. В ізоелектричній точці білок максимально інертний, не переміщається в електричному полі і має найтоншу гідратну оболонку.
Білки виявляють буферні властивості, та їх буферна ємність незначна. Виняток становлять білки, що містять велику кількість залишків гістидину. Наприклад, гемоглобін, що міститься в еритроцитах, за рахунок дуже високого вмісту залишків гістидину має значну буферну ємність при рН близько 7, що дуже важливо для тієї ролі, яку відіграють еритроцити в переносі кров'ю кисню і вуглекислого газу.
Для білків характерна розчинність у воді, причому з фізичного погляду вони утворюють справжні молекулярні розчини. Однак для розчинів білків характерні деякі колоїдні властивості: ефект Тендалю (явище світлорозсіювання), нездатність проходити через напівпроникні мембрани, висока в'язкість, утворення гелів.
Розчинність білка сильно залежитьвід концентрації солей, тобто від іонної сили розчину. У дистильованій воді білки найчастіше розчиняються погано, проте їх розчинність зростає зі збільшенням іонної сили. При цьому все більше гідратованих неорганічних іонів зв'язується з поверхнею білка і тим самим зменшується ступінь його агрегації. При високій іонній силі іони солей забирають гідратну оболонку у молекул білка, що призводить до агрегації та випадання білків в осад (явище висолювання). Використовуючи різницю в розчинності, можна за допомогою звичайних солей розділити суміш білків.
До біологічних властивостей білківвідносять насамперед їх каталітичну активність. Інша важлива біологічна властивість білків - їхня гормональна активність, тобто здатність впливати на цілі групи реакцій в організмі. Деяким білкам притаманні токсичні властивості, патогенна активність, захисні та рецепторні функції, відповідальність за явища клітинної адгезії.
Ще одна своєрідна біологічна властивість білків- Денатурація. Білки в них природному станізвуться нативних. Денатурація - це руйнація просторової структури білків при дії агентів, що денатурують. Первинна структура білків при денатурації не порушується, але втрачається їхня біологічна активність, а також розчинність, електрофоретична рухливість та деякі інші реакції. Радикали амінокислот, що формують активний центр білка, при денатурації виявляються просторово віддаленими один від одного, тобто руйнується специфічний центр зв'язування білка з лігандом. Гідрофобні радикали, які зазвичай знаходяться в гідрофобному ядрі глобулярних білків, при денатурації виявляються на поверхні молекули, тим самим створюються умови для агрегації білків, які випадають в осад.
Реагенти та умови, що викликають денатурацію білків:
Температура вище 60 про З - руйнація слабких зв'язків у білку,
Кислоти та луги - зміна іонізації іоногенних груп, розрив іонних та водневих зв'язків,
Сечовина - руйнування внутрішньомолекулярних водневих зв'язків у результаті утворення водневих зв'язків з сечовиною,
Спирт, фенол, хлорамін - руйнування гідрофобних та водневих зв'язків,
Солі важких металів - утворення нерозчинних солей білків з іонами важких металів.
При видаленні денатуруючих агентів можлива ренативація, оскільки пептидна ланцюг прагне прийняти в розчині конформацію з найменшою вільною енергією.
В умовах клітини білки можутьмимовільно денатурувати, хоча і з меншою швидкістю, ніж при високій температурі. Мимовільна ренативація білків у клітині утруднена, оскільки через високу концентрацію існує велика ймовірність агрегації частково денатурованих молекул.
У клітинах є білки- молекулярні шаперони, які мають здатність зв'язуватися з частково денатурованими, що знаходяться в нестійкому, схильному до агрегації стані білками та відновлювати їх нативну конформацію. Спочатку ці білки були виявлені як білки теплового шоку, тому що їх синтез посилювався при стресових впливах на клітину, наприклад, підвищення температури. Шаперони класифікуються за масою субодиниць: hsp-60, hsp-70 та hsp-90. Кожен клас включає сімейство родинних білків.
Молекулярні шаперони ( hsp-70)висококонсервативний клас білків, що знаходиться у всіх відділах клітини: цитоплазмі, ядрі, ендоплазматичному ретикулумі, мітохондріях. На С-кінці єдиного поліпептидного ланцюга hsp-70 має ділянку, яка являє собою борозенку, здатну взаємодіяти з пептидами довжиною 7-9 амінокислотних залишків, збагачених гідрофобними радикалами. Такі ділянки у глобулярних білках зустрічаються приблизно через кожні 16 амінокислот. Hsp-70 здатні захищати білки від температурної інактивації та відновлювати конформацію та активність частково денатурованих білків.
Шаперони-60 (hsp-60)беруть участь у формуванні третинної структури білків. Hsp-60 функціонують у вигляді олігомерних білків, що складаються з 14 субодиниць. Hsp-60 утворюють два кільця, кожне кільце складається з 7 субодиниць, з'єднаних один з одним.
Кожна субодиниця складається з трьох доменів:
Апікальний домен має ряд гідрофобних амінокислотних залишків, звернених усередину порожнини, що формується субодиницями;
Екваторіальний домен має АТФазну активність, необхідний для вивільнення білка з шаперонінового комплексу;
Проміжний домен з'єднує апікальний та екваторіальний домени.
Білок, що має на своїй поверхні фрагменти, збагачені гідрофобними амінокислотами, потрапляє в порожнину шаперонінового комплексу У специфічному середовищі цієї порожнини за умов ізольованості з інших молекул цитозолю клітини вибір можливих конформацій білка відбувається до того часу, доки знайдено енергетично вигідніша конформація. Шаперонзалежне формування нативної конформації пов'язане з витрачанням значної кількості енергії, джерелом якої є АТФ.
Білки- природні поліпептиди із величезною молекулярною масою. Вони входять до складу всіх живих організмів та виконують різні біологічні функції.
Будова білка.
У білків існує 4 рівні будови:
- первинна структура білка- лінійна послідовність амінокислот у поліпептидному ланцюгу, згорнутих у просторі:
- вторинна структура білка- Конформація поліпептидного ланцюга, т.к. скручування в просторі за рахунок водневих зв'язків між NHі СОгрупами. Є 2 способи укладання: α -спіраль та β - Структура.
- третинна структура білка- це тривимірне уявлення закрученої α -спіраль або β -структури у просторі:

Ця структура утворюється за рахунок дисульфідних містків -S-S-між цистеїновими залишками. У освіті такої структури беруть участь протилежно заряджені іони.
- четвертинна структура білкаутворюється за рахунок взаємодії між різними поліпептидними ланцюгами:

Синтез білка.
В основі синтезу лежить твердофазний метод, у якому перша амінокислота закріплюється на полімерному носії, а до неї послідовно підшиваються нові амінокислоти. Після цього полімер відокремлюють від поліпептидного ланцюга.
Фізичні властивості білка.
Фізичні властивості білка визначаються будовою, тому білки ділять на глобулярні(розчинні у воді) та фібрилярні(Нерозчинні у воді).
Хімічні властивості білків.
1. Денатурація білка(руйнування вторинної та третинної структури із збереженням первинної). Приклад денатурації – згортання яєчних білків при варінні яєць.
2. Гідроліз білків- незворотне руйнування первинної структури в кислому або лужному розчині з утворенням амінокислот. Так можна встановити кількісний склад білків.
3. Якісні реакції:
Біуретова реакція- взаємодія пептидного зв'язку та солей міді (II) у лужному розчині. Після закінчення реакції розчин забарвлюється у фіолетовий колір.
Ксантопротеїнова реакція- при реакції з азотною кислотоюспостерігається жовте забарвлення.
Біологічне значення білка.
1. Білки - будівельний матеріалз нього побудовані м'язи, кістки, тканини.
2. Білки – рецептори. Передають та сприймають сигнал, що надходять від сусідніх клітин із навколишнього середовища.
3. Білки відіграють важливу роль імунній системі організму.
4. Білки виконують транспортні функції та переносять молекули чи іони у місце синтезу чи накопичення. (Гемоглобін переносить кисень до тканин.)
5. Білки – каталізатори – ферменти. Це дуже потужні селективні каталізатори, які прискорюють реакцію в мільйони разів.
Є ряд амінокислот, які не можуть синтезуватися в організмі. незамінні, їх одержують лише з їжею: тизин, фенілаланін, метінін, валін, лейцин, триптофан, ізолейцин, треонін.